Você sabe se é possível controlar o tempo em que ocorre uma reação química? E como explicar que algumas reações ocorrem mais rapidamente do que outras? Vamos relembrar?
Você tem alguma ideia do que é a cinética química?
A cinética química é uma ramo da química que estuda a taxa de desenvolvimento (rapidez ou velocidade) das reações e os fatores que a influenciam.
Além disso, estuda também a possibilidade de controlar essa taxa de rapidez, tornando as reações ainda mais rápidas ou lentas, com base no mecanismo das reações.
Dica 1 – Veja o que mais cai em Química no Enem, e as principais dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Para entender melhor o que é cinética química, assista ao vídeo a seguir que te dará uma introdução a este assunto.
Existem reações muito rápidas como a reação do sódio com a água, reações lentas como o apodrecimento de uma fruta e também reações que demoram anos como a formação do petróleo.

Você deve estar pesando, mas porque essa diferença de comportamento?
Para que as substâncias reajam quimicamente são necessárias duas condições fundamentais:
- Contato entre os reagentes;
- Possibilidade de reação.
Dica: entenda melhor a cinética química com nossas aulas para o Enem
Você lembra de alguns conceitos muito importantes para a cinética química como a teoria das colisões,energia de ativação e complexo ativado?Não? Então assista ao vídeo totalmente gratuito de Chemisterman e relembre de forma fácil esses conceitos.
Só para reforçar!
A teoria das colisões: Explica os fatores que influenciam na rapidez das reações. De acordo com essa teoria os aglomerados das substâncias reagentes devem colidir para que a reação química ocorra.
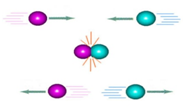
A energia de ativação: Energia de ativação (Ea), é a energia mínima que as moléculas devem ter para que a colisão seja favorável e, assim, ocorra a reação.
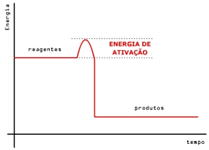
Complexo ativado : É a formação de um intermediário, resultante das colisões, em que todas as partículas das substâncias reagentes estão agregadas, sendo esse intermediário, portanto, muito instável e energético.
Mas como podemos expressar a rapidez de uma reação?
Ela pode ser expressa pela variação de alguma grandeza relacionada com a quantidade de reagente ou produto (concentração, quantidade de matéria, pressão, massa, volume) por unidade de tempo.
Veja:
![]()
Entendeu? Não? Então assita a videoaula do Descomplica com o professor Carlos Vitorino e veja mais explicações de como calcular a rapidez de uma reação química e mande super bem nas questões do Enem e dos vestibulares:
Veja o exemplo de exercício sobre cinética química:
A reação de decomposição da amônia gasosa foi realizada em um recipiente fechado:
2 NH3 → N2 + 3 H2
A tabela abaixo indica a variação na concentração de reagente em função do tempo.
| Concentração de NH3 em mol L-1 |
8,0 |
6,0 |
4,0 |
1,0 |
| Tempo em horas |
0 |
1,0 |
2,0 |
3,0 |
Qual é a velocidade média de consumo do reagente nas duas primeiras horas de reação?
Resolução:
Utilizando a fórmula:
![]()
Temos que:
![]()
Resposta:
Relembrou? Que tal um desafio sobre cinética química?
(ITA-2009) Considere a reação química representada pela seguinte equação:
4NO2(g) + O2(g) → 2NO5(g)
Num determinado instante de tempo t da reação, verifica-se que o oxigênio está sendo consumido a uma velocidade de 2,4 x 10-2 mol L-1 s-1. Nesse tempo t, a velocidade de consumo NO2 será de:
(A) 6,0 x 10-3 mol L-1 s-1
(B) 1,2 x 10-2 mol L-1 s-1
(C) 2,4 x 10-2 mol L-1 s-1
(D) 4,8 x 10-2 mol L-1 s-1
(E) 9,6 x 10-2 mol L-1s-1
Resposta: E
Dica 2: Veja também outro assunto de química bastante cobrado no enem e nos vestibulares que é diagrama de fases. Não deixe essa chance passar! https://blogdoenem.com.br/quimica-diagrama-de-fases/
Dica 3 – Complemente seus estudos acessando o nosso Blog do Enem e conferindo um super-resumo preparado especialmente para você sobre a matéria. Não deixe de estudar! https://blogdoenem.com.br/quimica-definir-materia/


