Estude tudo sobrea energia produzida pelas Pilhas com Células Galvânicas. Na prática, acontece ali uma reação química de Oxidação e de Redução. Veja agora:
As Pilhas (Células Galvânicas), produzem energia a partir de “Uma reação de oxidação-redução (redox) espontânea é usada para produzir eletricidade.”
Você entendeu esta frase, ou quer fazer uma revisão de Oxidação e de Redução antes de continuar? Você lembra?
- Oxidação é a perda de elétrons por um elemento químico, ou seja, aumento do seu número de oxidação.
- Redução é o ganho de elétrons por um elemento químico, ou seja, diminuição do seu número de oxidação.
Para ajudar a refrescar a sua memória, veja este resumo sobre Oxidação e redução, que logo em seguida você vai entender o funcionamento das pilhas nas Células Galvânicas
Resumo de Eletroquímica – Veja Oxidação e Redução
Confira na aula gratuita do professor Felipe Sobis, do canal do Curso Enem Gratuito.
.
A Eletroquímica é um ramo da Química que estuda o fenômeno da transferência de elétrons para a transformação de energia química em energia elétrica e vice-versa. O tema da Oxidação e da Redução é recorrente no Enem e vestibulares.
Confira o exemplo das Pilhas de Zinco
Ex.: Pilhas de Zinco/Cobre.
Equação global
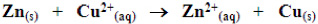
Semi-reações
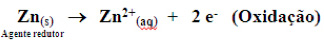
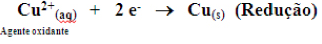
Componentes das pilhas
1. Cátodo® onde ocorre a redução, ou seja, onde os elétrons chegam. No exemplo: (Cu).
No cátodo, ocorre eletrodeposição, ou seja, o cobre II é reduzido a Cu metálico aumentando a massa da placa de cobre.
2. Ânodo® onde ocorre a oxidação, ou seja, onde saem os elétrons. No exemplo: (Zn). No ânodo, ocorre corrosão, ou seja, o Zn metálico é oxidado a Zn II o qual vai para a solução, diminuindo massa da placa de zinco.
3. Ponte salina
(a) separa fisicamente os compartimentos eletródicos.
(b) continuidade elétrica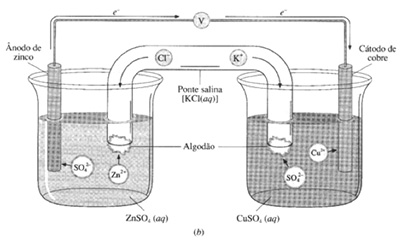
Como funcionam as pilhas: veja no resumo de Química
Confira agora com a professora Larissa Marques, do canal do Curso Enem Gratuito, os fundamentos da Eletroquímica que está na origem as pilhas e baterias:
Pilhas Zn/Cu
Diagrama de uma pilha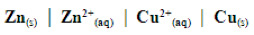
a representação normalmente coincide com o sentido do fluxo de elétrons.
Quando uma ponte salina está presente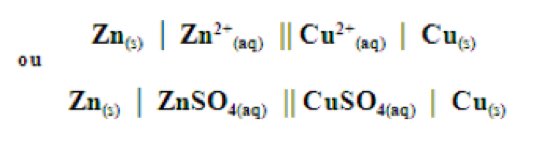
Diferença de potencial (ddp) ou voltagem de uma pilha (E0)
“E0 é a voltagem medida em uma pilha quando todos os íons e moléculas em solução estão na concentração de 1 M e todos os gases na pressão de 1 bar” .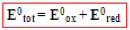
Ex.: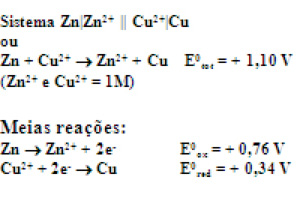
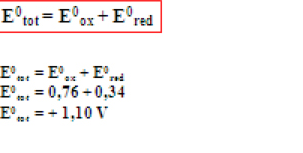

Quanto maior E0tot mais espontânea é a reação.
Desafios sobre as Pilhas
Questão 1
(UFSM)
A cela combustível de hidrogênio-oxigênio usada em cápsulas espaciais gera energia e tem como único produto a água.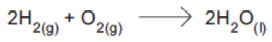
Os potenciais-padrão das semi reações da cela combustível, a 25 ºC, são: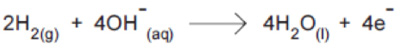
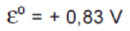
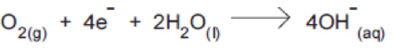
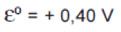
Sobre essa cela, é correto afirmar que:
I- a concentração de O2(g) aumenta durante a reação.
II- o hidrogênio perde elétrons, portanto é o agente redutor.
III- o oxigênio recebe elétrons com facilidade.
Está(ão) correta(s) a(s) afirmativa(s):
a) apenas I.
b) apenas II.
c) apenas III.
d) apenas I e II.
e) apenas II e III.
Dica 1 – Relembre tudo sobre Equilíbrio Iônico em mais esta aula preparatória para a prova de Química Enem. Estude com a gente para o Exame Nacional do Ensino Médio! – https://blogdoenem.com.br/equilibrio-ionico-quimica-enem/
Questão 2
(UFSM)
Nos solos alagados, onde a concentração de oxigênio é baixa, os micro-organismos catalisam a decomposição da matéria orgânica utilizando o íon nitrato (NO3–) como agente oxidante.
Em solos alagados, a decomposição da glicose ocorre segundo a reação não-balanceada.
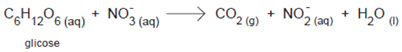
Nessa reação de oxirredução:
I. o íon nitrato é um aceptor de elétrons.
II. o coeficiente estequiométrico do íon nitrato na equação balanceada é 6.
III. o coeficiente estequiométrico do CO2 na equação balanceada é 4.
Está(ão) correta(s) a(s) afirmativa(s):
a) I apenas.
b) II apenas,
c) III apenas.
d) I e II apenas.
e) I e III apenas.
Dica 2 – Tire todas as suas dúvidas e fique preparado para a prova de Química Enem com mais esta aula sobre o Equilíbrio Químico. – https://blogdoenem.com.br/equilibrio-quimico-quimica-enem/
Questão 3
(ENEM)
Pilhas e baterias são dispositivos tão comuns em nossa sociedade que, sem percebermos, carregamos várias delas junto ao nosso corpo; elas estão presentes em aparelhos de MP3, relógios, rádios, celulares, etc. As semirreações descritas a seguir ilustram o que ocorrem em uma pilha de óxido de prata.
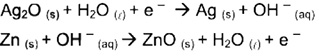
Pode-se afirmar que esta pilha:
a) É uma pilha ácida.
b) Apresenta o óxido de prata como o ânodo.
c) Apresenta o zinco como agente oxidante.
d) Tem como reação de célula a seguinte reação:
Zn(s) + Ag2O(s) → ZnO(s) + 2 Ag(s).
e) Apresenta fluxo de elétrons na pilha do eletrodo de Ag2O para o Zn.
Dica 3 – Estude sobre os fatores que influenciam uma reação química e a Natureza dos Reagentes em mais uma aula preparatória para a prova de Química Enem – https://blogdoenem.com.br/natureza-dos-reagentes-quimica-enem/
Questão 4
(ENEM)
O crescimento da produção de energia elétrica ao longo do tempo tem influenciado decisivamente o progresso da humanidade, mas também tem criado uma séria preocupação: o prejuízo ao meio ambiente.
Nos próximos anos, uma nova tecnologia de geração de energia elétrica deverá ganhar espaço: as células a combustível hidrogênio/oxigênio.
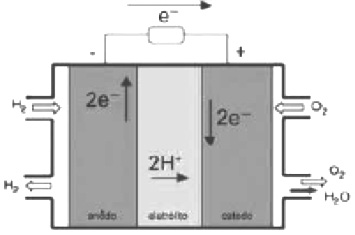
Com base no texto e na figura, a produção de energia elétrica por meio da célula a combustível hidrogênio/oxigênio diferencia-se dos processos convencionais porque:
a) transforma energia química em energia elétrica, sem causar danos ao meio ambiente, porque o principal subproduto formado é a água.
b) converte a energia química contida nas moléculas dos componentes em energia térmica, sem que ocorra a produção de gases poluentes nocivos ao meio ambiente.
c) transforma a energia química em energia elétrica, porém emite gases poluentes da mesma forma que a produção de energia a partir de combustíveis fósseis.
d) converte a energia elétrica proveniente dos combustíveis fósseis em energia química, retendo os gases poluentes produzidos no processo sem alterar a qualidade do meio ambiente.
e) converte a energia potencial acumulada nas moléculas de água contidas no sistema em energia química, sem que ocorra a produção de gases poluentes nocivos ao meio ambiente.
Questão 5
(UDESC)
Uma importante aplicação das células galvânicas é seu uso nas fontes portáteis de energia a que chamamos de baterias. Considerando a reação espontânea de uma bateria alcalina descrita abaixo, é correto afirmar:
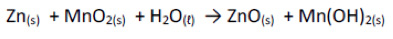
a) Zinco metálico é o agente redutor, pois sofreu redução no ânodo, perdendo dois elétrons.
b) O óxido de manganês sofre oxidação no cátodo, ao ganhar dois elétrons.
c) O óxido de manganês sofre redução no ânodo, ao ganhar dois elétrons.
d) Zinco metálico é o agente redutor, pois sofreu oxidação no cátodo, perdendo dois elétrons.
e) Zinco metálico é o agente redutor, pois sofreu oxidação no ânodo, perdendo dois elétrons.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!

