Bora fazer a diferença nos pontos do Enem acertando as questões de Equilíbrio Químico. Quem acerta uma destas, já abre vantagem. Vem revisar um pouco de equilíbrio químico!
Esta matéria assusta muita gente. Mas com as dicas dos professores do Curso Enem Gratuito e do Blog do Enem, fica mais fácil. Você vai aprender o Equilíbrio Químicao e nunca mais esquecer. E, o mais importante: têm exercicios resolvidos para você dominar como fazer.
O que é o Equilíbrio químico? – Vejauma resposta direta para sempre lembrar: Equilíbrio Químico é uma situação em que a proporção entre as quantidades de reagentes e produtos em uma reação química se mantém constante ao longo do tempo.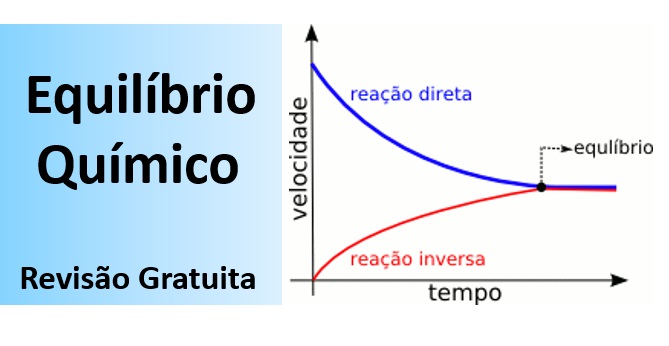 Complicou, ou você entendeu ‘de primeira’? – Se ainda não deu, vamos ver de outra forma, para ajudar você a compreender: O Equilíbrio Químico ocorre em reações que são reversíveis.
Complicou, ou você entendeu ‘de primeira’? – Se ainda não deu, vamos ver de outra forma, para ajudar você a compreender: O Equilíbrio Químico ocorre em reações que são reversíveis.
Resumo sobre o Equilíbrio Químico
Veja agora com o professor de Química Felipe Sobis, do canal do Curso Enem Gratuito. Depois tem o vídeo com exercícios resolvidos, com a professora Larissa Marques. Confira:
Traduzindo Equilíbrio Químico em outras palavras:
As reações em que ocorrem o Equilívrio Químico são aquelas onde reagentes formam produtos e os produtos restituem os reagentes, sendo que na situação de equilíbrio essas transformações ocorrem com velocidades iguais, o que mantém as concentrações, tanto de produtos, quanto de reagentes constantes. Observe no gráfico acima, que agora você vai compreender sem problemas.
 As reações químicas podem ocorrer de várias maneiras, em alguns casos elas ocorrem de forma completa, ou seja, os reagentes são consumidos durante o processo. Por exemplo, quando queimamos uma folha de papel essa passa a não existir mais, de forma que é impossível recuperar sua forma original. Esse tipo de reação se classifica como irreversível.
As reações químicas podem ocorrer de várias maneiras, em alguns casos elas ocorrem de forma completa, ou seja, os reagentes são consumidos durante o processo. Por exemplo, quando queimamos uma folha de papel essa passa a não existir mais, de forma que é impossível recuperar sua forma original. Esse tipo de reação se classifica como irreversível.
Reações Reversíveis
Em outro caso, existem reações reversíveis onde os produtos podem se converter a sua forma original. Isso pode ocorrer em processos químicos e físicos e são identificados pela seta dupla: ![]() Não se lembra de como pode funcionar uma reação reversível?
Não se lembra de como pode funcionar uma reação reversível?
Veja o exemplo abaixo. Cai na FUVEST, Enem e outros vestibulares! Se você colocar água líquida em um recipiente fechado vai ter uma reação reversível através da equação: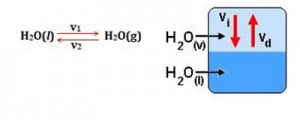
Tanto a vaporização quanto a condensação ocorrem sob a mesma velocidade, e as quantidades relativas de líquido e vapor permanecem constantes no decorrer do tempo. Quando a velocidade de vaporização se iguala à de condensação, o sistema entra em equilíbrio.
Quer entender melhor o equilíbrio químico? Veja a aula do Curso Enem Gratuito que o prof. Sobis te ajuda!
Dica – O que mais cai em Química nos Vestibulares, na FUVEST e no Enem? Veja aqui as melhores dicas.
Veja o Princípio de Le Chatelier
Quando se aplica uma força em um sistema em equilíbrio, ele tende a se reajustar no sentido de diminuir os efeitos dessa força. Mas, que tipo de forças são essas? Veja um exemplo:
Alterações da acidez e basicidade agem como forças externas em equilíbrios químicos. O sistema precisa então se deslocar para amenizar os efeitos dessa força. Vejamos um exemplo de fator que pode alterar o equilíbrio de um sistema: a concentração.
2 CrO2-4 (aq) + 2 H+ (aq) ↔ CrO2-7 (aq) + H2O (l)
Se adicionarmos algumas gotas de limão (solução ácida) neste equilíbrio, ele irá se deslocar para a direita ou para a esquerda e favorecer a formação de um dos produtos. Isso porque através desta ação aumentamos a quantidade de íons H+ em um dos membros da equação.
Se isso ocorre nos reagentes à esquerda, o equilíbrio se desloca para a direita, para se equilibrar. Vamos saber mais um pouco sobre o princípio de Le Chatelier? Acesse o nosso blog do Enem e veja outros exemplos.
Dica 3 – Veja dicas de revisão para o vestibular, ou Enem em poucas semanas!
Você lembra quais os outros fatores que alteram o equilíbrio químico? Que tal relembrar? Cai bastante nos vestibulares e na prova do Enem.
Concentração
- Considere o equilíbrio químico:
- C(s) + CO2 (g) 2 CO (g)
- Se adicionarmos mais dióxido carbônico ao equilíbrio, este se desloca para a direita, vejamos a razão!
Aumento de CO2 (g) acarreta em maior número de choques com C (s) e consequente aumento da velocidade da reação, o que favorece a formação de monóxido de carbono – CO (g). Dizemos então que a concentração do reagente interferiu sobre o equilíbrio.
Pressão
Se considerarmos o equilíbrio como sendo gasoso a uma temperatura constante, teremos um deslocamento do equilíbrio no sentido de diminuir o aumento da pressão. Exemplo:
2 SO2 (g) + O2 (g) 2 SO3 (g)
2 mol 1 mol 2 mol
Repare que a soma da quantidade de mols para os reagentes (3 mol) é maior do que o produto (2 mol).
Um aumento de pressão no sistema favorece a formação de SO3 (g) porque nesse sentido há uma diminuição do número de mol do gás. O equilíbrio tende a deslocar para o lado de menor volume (menor número de mol) e assim a pressão também diminui.
Se diminuirmos a pressão haverá uma expansão de volume dos reagentes e com isso o equilíbrio desloca-se para a esquerda (maior número de mol).
Temperatura
Considerando que em um equilíbrio ocorre tanto reações endotérmicas como exotérmicas, conforme a equação:
exotérmica N2 (g) + 3 H2 (g) 2 NH3 (g) endotérmica
Temos que:
- Aumento de temperatura do sistema: o equilíbrio se desloca para a esquerda (Reação endotérmica), para que o calor seja absorvido e não afete o equilíbrio.
- Diminuição de temperatura do sistema: o equilíbrio é deslocado para a direita (Reação exotérmica), para compensar o calor retirado do equilíbrio.
Equilíbrio Químico – Exercícios Resolvidos
Veja agora, com a professora Larissa Marques, a resolução explicada. Tem um exercício fácil, um médio, e um difícil. Todos resolvidos.
Deu para relembrar? Que tal mais um super- resumo sobre os fatores que alteram o equilíbrio químico? Acesse o nosso site! Tem explicações e exercícios resolvidos!
“Imagine uma nova história para sua vida e acredite nela”