Relembre sobre os princípios da Estequiometria em mais esta aula de revisão de Química para Vestibular e Enem. Não tem moleza. Quem acerta uma questão de Cálculo Estequiométrico já sai na frente dos concorrentes. Confira abaixo.
Você lembra das aulas sobre o Cálculo Estequiométrico? Não? Então agora é a hora de recuperar tudo no resumo de Estequiometria. Assim você chega com tudo para gabaritar nas questões de Química do Enem.
O que é a Estequiometria? – A Estequiometria envolve o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas. Este é, portanto, o Cálculo Estequiométrico.
As Três Leis das reações químicas: Leis Ponderais
Elas estão na base de tudo. Com elas você entra na essência deste resumo de Estequimetria. São as seguintes as Leis Ponderais: a Lei de Antoine Lavoisier, que definiu a conservação das massas; a Lei de Proust, que trata das proporções fixas; e a Lei de Dalton, que fala das proporções múltiplas.
Confira no resumo de Estequiometria:
1 – A Lei de Lavoisier ou lei da conservação das massas – a soma das massas dos reagentes é igual à soma das massas dos produtos.
2- A Lei de Proust ou lei das proporções fixas – a proporção em massa das substâncias que reagem e que são produzidas em uma reação química é sempre constante e invariável.
3 – A Lei de Dalton ou lei das proporções múltiplas – quando duas substâncias puras simples reagem entre si para formar compostos diferentes, se a massa de uma delas permanecer constante, a massa da outra substância irá variar numa relação de números múltiplos inteiros.
Resumo de Estequiometria
Veja agora com o professor Felipe Sobis, do canal do Curso Enem Gratuito, uma introdução completa, com o resumo de Estequiometria essencial.
A dica do Sobis:
- Aprenda na aula acima como calcular a quantidade de produto formada em uma reação química.
- Estequiometria é o cálculo que permite relacionar as quantidades de reagentes e produtos, que participam de uma reação química, com o auxilio da reação química correspondente.
Veja as Leis volumétricas
1ª lei de Gay-Lussac – nas mesmas condições de temperatura e pressão, os volumes gasosos de reagentes e produtos estão em uma proporção constante de números inteiros.
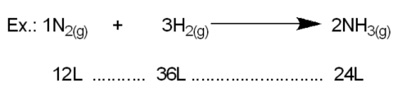
Proporção 1:3:2
2ª lei de Gay-Lussac – quando duas substâncias na fase gasosa reagem entre si para formar compostos diferentes, se o volume de uma delas permanecer constante, o volume da outra substância irá variar numa relação de números inteiros.
Cálculo estequiométrico – Regras fundamentais
1ª – Escrever a equação química mencionada no problema.
2ª – Acertar os coeficientes dessa equação (proporção molar entre reagentes e produtos).
3ª – Estabelecer a proporção entre os reagentes e produtos (regra de três) entre os dados que possuímos e o que desejamos encontrar.
Exercício resolvido de Cálculo Estequiométrico
Confira com a professora Larissa Santos, do Curso Enem Gratuito, exemplos com Exercícios de Estequiometria:
As relações de proporções (regra de três) podem ser realizadas das seguintes formas:
- Massa—————————Massa
- Massa—————————Volume
- Volume————————-Volume
- Massa—————————mols
- Massa—————————Nº de moléculas
- E assim por diante.
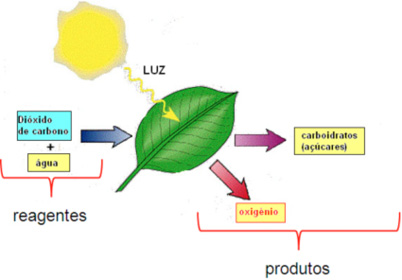
Veja este Exemplo:
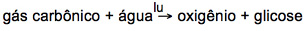
 Reação química balanceada
Reação química balanceada
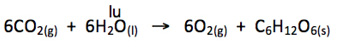
Razão molar
A equação acima nos diz que:
6 moléculas de CO2 e 6 moléculas de H2O reagem para formar 6 moléculas de O2 e 1 molécula de C6H12O6
ou
6 mol de CO2 e 6 mol de H2O reagem para formar 6 mol de O2 e 1 mol de C6H12O6
A razão molar da reação acima é:
6 mol de CO2:6 mol de H2O:6 mol de O2:1 mol de C6H12O6
Casos particulares de cálculos estequiométricos
1º Caso – Quando temos reações consecutivas
Podemos somar algebricamente as equações químicas e efetuar o cálculo estequiométrico diretamente na equação final.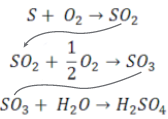
2º Caso – Reagentes impuros
Grau de pureza – é o quociente entre a massa (m) da substância principal e a massa (M) total da amostra (ou massa do material bruto).
Primeiramente é necessário descobrir a real massa do reagente no material bruto.
Ex.: Deseja-se obter 180L de dióxido de carbono, medidos nas CNTP, pela calcinação de um calcário de 90% de pureza. Qual a massa de calcário necessária? (C=12 g/mol; O=16 g/mol; Ca=40 g/mol).
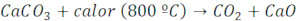
100g————————————-22,4L
Mx0,90———————————-180L
M=892,8 g de calcário
3º Caso – Rendimento
Rendimento teórico: quantidade máxima de produtos que pode ser obtida a partir de certa quantidade de reagentes (segue a estequiometria da reação).
Rendimento real: quantidade real de produto obtido experimentalmente.
4º Caso – Reagente limitante:
É o reagente que governa o rendimento máximo de produto. O rendimento deve ser calculado com base na quantidade de reagente limitante.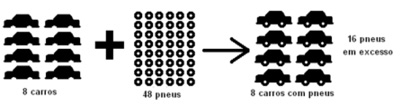
Como saber qual o reagente limitante?
Converter as quantidades de reagentes em números de mols. Comparar estas quantidades com a proporção estequiométrica dada pela reação balanceada.
Pela equação balanceada: 8 carros + 32 pneus → 8 carros com pneus
Dados: 8 carros: 48 pneus → carros são limitantes!
sobram 16 pneus em excesso!
Pela lei de Proust temos 8 carros: 32 pneus
A razão 8/32 é a relação ideal, porém a razão em questão é 8/48.
8/32 > 8/48 logo o excesso é do denominador.
Para verificar a existência de excesso é necessário verificar as relações de proporções entre reagentes e produtos na equação fundamental e comparar com a relação dada no exercício. Caso sejam diferentes, têm-se excessos.
O Rendimento numa reação química
As dicas da Larissa:
- Geralmente estudamos exemplos de fenômenos ideais para simplificar os estudos em química.
- Porém, uma reação química não pode ser considerada como um sistema ideal. Isso porque não podemos prever a quantidade de produto que será formada a partir dessa reação com exatidão.
- Vários fatores difíceis de serem controlados podem estar envolvidos em um processo laboratorial, e estes fatores podem contribuir para que a reação química não alcance o rendimento calculado na teoria.
- O rendimento de uma reação química é a relação entre a quantidade realmente obtida de produto e a quantidade teoricamente calculada.
- Nesta aula acima, a professora Larissa te ensina a calcular o rendimento de uma reação química.
- Vem, e complete a revisão no Resumo de Estequiometria 😉
Desafios do Resumo de Estequiometria
Questão 1 – Resolva e compartilhe o resultado
Uma amostra de gasolina (densidade= 0,910 g/mL) apresenta 3,52% em massa de enxofre (S). Sabendo-se que o S (32 g/mol) ao ser queimado em excesso de oxigênio, produz apenas SO2(g), um dos gases responsáveis pela formação de chuva ácida.
O volume em litros de SO2(g) produzido na queima de 1L dessa gasolina, nas CNTP é de:
a) 20 mL
b) 22,4 L
c) 2,24 L
d) 1 L
e) 32 L
Dica 1 – É fácil medir o peso de qualquer coisa, mas como podemos medir o peso de um átomo? Saiba tudo sobre as Grandezas Químicas nesta aula de Química Enem – https://blogdoenem.com.br/grandezas-quimicas-quimica-enem/
Questão 2 – Resumo de Estequiometria
(UDESC)
Os compostos reduzidos de enxofre, principalmente o sulfeto de hidrogênio (H2S), um gás de cheiro desagradável, são formados por atividade bacteriana anaeróbica em “lixões”. Ele pode ser removido do ar por uma variedade de processos, entre eles, o bombeamento através de um recipiente com óxido de ferro (III) hidratado, o qual se combina com sulfeto de hidrogênio:
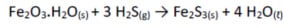
(Fe= 56 g/mol; S= 32 g/mol; O= 16 g/mol; H= 1g/mol).
Se 208 g de Fe2S3 são obtidos pela reação, qual a quantidade de H2S removidos? Considere que Fe2O3.H2O está em excesso e que o rendimento da reação é de 100%.
a) 68 g
b) 51 g
c) 34 g
d) 102 g
e) 208 g
Resposta: D
Dica 2 – Relembre tudo sobre os processos de separação de misturas homogêneas e heterogêneas em mais esta aula de revisão para a prova de Química Enem – https://blogdoenem.com.br/separacao-de-misturas-quimica-enem/
Questão 3
A reação abaixo mostra a reação envolvida no processo de obtenção do formaldeído (CH2O) a partir do metanol (CH3OH), por reação com o O2 em presença de prata como catalisador. Sabendo-se que o rendimento da reação é de apenas 10%, a massa de formaldeído obtida pela reação de 320 g de metanol é. (C= 12 g/mol; O= 16 g/mol; H= 1 g/mol).
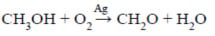
a) 300 g
b) 15 g
c) 150 g
d) 200 g
e) 30 g
Resposta: E
Dica 3 – Tire todas as suas dúvidas sobre os Tipos de Misturas Químicas em mais uma aula de Química Enem que preparamos para você – https://blogdoenem.com.br/sistemas-e-misturas-quimica-enem/

