Relembre sobre Calor Sensível e Calor Latente nesta aula de Física Enem. Estude conosco e fique preparado para o Exame Nacional do Ensino Médio e o Vestibular. Aula gratuita com exercícios. Confira abaixo.
Você lembra das aulas sobre Calor Sensível e Calor Latente? São conteúdos ‘quentes’ de Física para o Enem. Veja na revisão abaixo.
O conceito de calor
Quando dois corpos, A e B, a temperaturas diferentes θA e θB, com θA > θB, são colocados em contato, por exemplo, uma porção de água a 70 °C e outra porção a 20 °C, observamos que, com o passar do tempo, parte da energia térmica das partículas de A (a água “mais quente”) é transferida às partículas de B (a água “mais fria”) até que ambos os corpos atinjam uma mesma temperatura final, no nosso exemplo, 30 °C.
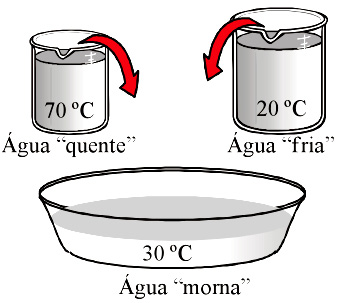
A esse estado, no qual os corpos têm uma mesma temperatura, damos o nome de equilíbrio térmico (figura b, abaixo). À energia térmica transferida espontaneamente do corpo “quente” para o corpo “frio” damos o nome de calor.
Note que não tem cabimento falarmos em calor contido em um corpo. Um corpo possui apenas “energia térmica” e só podemos falar em calor quando nos referimos à transferência dessa energia térmica de um corpo para outro. Assim:
|
Calor é energia térmica em trânsito entre corpos a temperaturas diferentes. |
Para avaliar o calor transferido entre os corpos usaremos a partir de agora a grandeza denominada quantidade de calor e geralmente representada por Q.
Por ser uma forma de energia, a quantidade de calor é medida no Sistema Internacional de Unidades pelo joule (J). Entretanto, por razões históricas, as unidades mais utilizadas para se medir a quantidade de calor são a caloria (cal) e a quilocaloria (kcal).
Dica 1 – Nesta aula de Física Enem vamos estudar sobre a Dilatação Térmica dos Líquidos e saber por que a água, ao ser aquecida, não reage como os outros líquidos – https://blogdoenem.com.br/dilatacao-termica-dos-liquidos-fisica-enem/
Por definição, uma caloria (1 cal) é a quantidade de calor que, ao ser recebida por 1 grama de água, provoca nessa água uma variação de temperatura de 1 °C (de 14,5 °C para 15,5 °C), sob pressão normal.
|
1 cal = 4,186 J 1 kcal = 1.000 cal |
O calor sensível e o calor latente
No exemplo anterior, admitimos que os corpos, ao trocarem calor entre si, sofreram apenas uma mudança de temperatura. Entretanto, existem situações nas quais o calor, recebido ou cedido por um corpo, pode provocar ainda uma mudança em seu estado físico.
Dica 2 – Fique pronto para o Exame Nacional do Ensino médio revisando sobre Dilatação Térmica do Sólidos nesta aula de Física Enem – https://blogdoenem.com.br/dilatacao-termica-dos-solidos-revisao-fisica-enem/
O esquema abaixo mostra o nome característico de cada mudança de estado físico que uma substância pode sofrer. Observe que algumas mudanças acontecem quando a substância absorve (recebe) calor, outras quando ela perde (cede) calor.
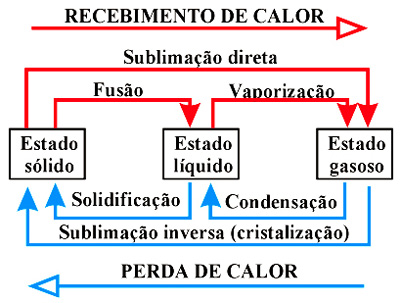
Na Física, mais especificamente na Calorimetria, trabalharemos apenas com corpos constituídos por substâncias puras, ou seja, corpos constituídos por apenas um tipo de grupamento atômico (moléculas). Como exemplo de substâncias puras podemos citar: água (apenas moléculas de H2O), metanol (CH3OH), ferro (apenas átomos de Fe), cobre, alumínio.
As substâncias puras comportam-se de maneira bastante característica ao receber calor ou ao perder calor: observa-se que quando uma substância pura recebe calor, ou quando ela perde calor, a mudança de temperatura e a mudança de estado físico não ocorrem simultaneamente.
Assim, se o calor estiver provocando uma mudança de temperatura, a substância não poderá ao mesmo tempo estar mudando de estado físico. Por outro lado, se o calor estiver provocando uma mudança de estado físico, a temperatura não poderá ao mesmo tempo estar variando.
Em outras palavras, quando uma substância pura recebe ou cede calor ela ou muda de temperatura ou muda de estado físico.
Chamamos de calor sensível o calor que, recebido ou cedido por uma substância, provoca apenas uma variação de temperatura da substância.
O calor que, recebido ou cedido pela substância, provoca apenas a mudança de estado físico da substância é chamado de calor latente.
Entenda mais sobre o calor sensível na aula:
A curva de aquecimento de uma substância pura
Damos o nome de curva de aquecimento ao diagrama que mostra a temperatura da substância em função do tempo ou da quantidade de calor recebido.
O diagrama abaixo mostra a curva de aquecimento de uma porção de água inicialmente a –20 ºC, que recebe calor até se converter em vapor d’água a 120 ºC.
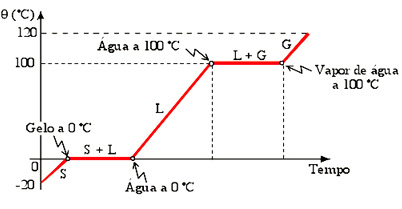
Note a presença de dois patamares: um à temperatura mais baixa (neste caso, a 0 °C) correspondente à fusão do material e outro a uma temperatura mais alta (neste exemplo, a 100 °C) que corresponde à vaporização da substância.
Assista às videoaulas do prof. Marcelo para aprofundar seus conhecimentos sobre calor latente e curva de aquecimento!
O calor sensível
Considere um corpo de massa m que, ao receber uma quantidade de calor Q, sofre uma variação de temperatura Δθ.
É intuitivo perceber que a quantidade de calor Q é diretamente proporcional à massa m do corpo e à variação de temperatura Δθ.
Isso significa que, para uma dada variação de temperatura, quanto maior a massa m maior a quantidade de calor Q necessária:
Significa também que, para uma dada massa, quanto maior a variação de temperatura Δθ maior a quantidade de calor Q necessária:
Essas duas constatações podem ser resumidas em uma expressão conhecida como equação fundamental da calorimetria, uma equação que fornece a quantidade de calor sensível Q que devemos fornecer ou retirar de um corpo de massa m para provocar-lhe uma variação de temperatura Δθ:
|
Q = m⋅c⋅ Δθ |
Nessa expressão: Q é a quantidade de calor sensível, em cal; m é a massa do corpo, em g; Δθ é a variação de temperatura, em ºC e c é o calor específico da substância (uma constante de proporcionalidade, característica da
substância e de seu estado físico), em
|
cal |
|
g ⋅ °C |
Para a água, temos:
C gelo = 0,5
|
cal |
|
g ⋅ °C |
C água líquida = 1,0
|
cal |
|
g ⋅ °C |
e
C vapor = 0,5
|
cal |
|
g ⋅ °C |
Na expressão acima, a grandeza física dada por m·c é uma característica importante do corpo. Tal grandeza, representada por C, é chamada capacidade térmica do corpo e pode ser medida em
|
cal |
|
°C |
. Assim:
C = m = c ou C =
|
Q |
|
Δθ |
O calor latente
O calor latente da mudança de estado de uma substância é calculado com base em uma constante física, denominada calor latente de (nome da mudança de estado) do(a) (substância), geralmente representada por L e medida em
|
cal |
|
g |
Consideremos, por exemplo, um material que, na sua temperatura de fusão, necessita receber 16 cal para a fusão completa de 1g dessa substância. Dizemos, então, que: Lfusão = 16
|
cal |
|
°C |
Por uma regra de três simples e direta podemos calcular a quantidade de calor latente Q necessária para a fusão de uma massa m dessa substância:
L→ 1g
Q→m
Resolvendo a regra de três, obtemos:
|
Q = m⋅L |
Essa expressão mostra que o calor Q que devemos fornecer ou retirar de uma substância para que ocorra uma mudança de estado físico é diretamente proporcional à massa m que mudará de estado físico. Ou seja, quanto maior a massa m, maior a quantidade de calor Q necessária.
Note que a massa m que comparece nessa expressão é a massa que muda de estado físico, enquanto que a massa m que comparece na expressão do calor sensível é a massa total do corpo que varia de temperatura.
Desafios
Questão 1
(UNIFESP–SP) O SI (Sistema Internacional de unidades) adota como unidade de calor o joule, pois calor é energia. No entanto, só tem sentido falar em calor como energia em trânsito, ou seja, energia que se transfere de um corpo a outro em decorrência da diferença de temperaturas entre eles. Assinale a afirmação em que o conceito de calor está empregado corretamente.
a) A temperatura de um corpo diminui quando ele perde parte do calor que nele estava armazenado.
b) A temperatura de um corpo aumenta quando ele armazena calor.
c) A temperatura de um corpo diminui quando ele cede calor para o meio ambiente.
d) O aumento da temperatura de um corpo é um indicador de que esse corpo armazenou calor.
e) Um corpo só pode atingir o zero absoluto se for esvaziado de todo o calor nele contido.
Questão 2
(PUC–RS) A temperatura de um corpo de 500 g varia conforme ilustra o gráfico.
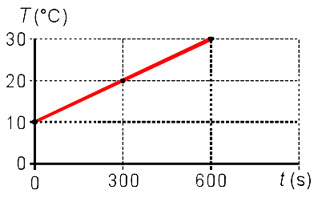
Sabendo-se que o corpo absorve calor a uma potência constante de 10,0 cal/s, conclui-se que o calor específico do material que constitui o corpo é:
a) 0,40 cal/(g·ºC).
b) 0,50 cal/(g·ºC).
c) 0,60 cal/(g·ºC).
d) 0,70 cal/(g·ºC).
e) 0,80 cal/(g·ºC).
Questão 3
(VUNESP–SP) Uma garrafa térmica possui em seu interior 1,0 kg de água a 80 ºC. Meia hora depois, a temperatura da água caiu para 50 ºC. Nessas condições, e lembrando que o calor específico da água é 1,0 cal/(g·ºC), o fluxo de calor perdido pela água foi em média de:
a) 1,0 cal/min.
b) 100 cal/min.
c) 500 cal/min.
d) 1.000 cal/min.
e) 4.180 cal/min.
Questão 4
(UEPG–PR) O diagrama abaixo representa a curva de aquecimento de 20 gramas de uma substância inicialmente no estado líquido.
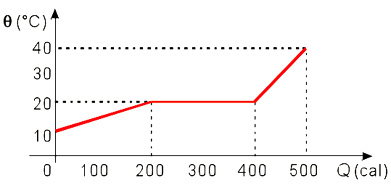
O calor latente de vaporização da substância é:
a) 10 cal/g
b) 20 cal/g
c) 25 cal/g
d) 30 cal/g
e) 40 cal/g
Questão 5
(UNEB–BA) Dispõem-se de 200 g de gelo a –10 ºC que recebem calor continuamente de uma fonte. Sendo a temperatura final do conjunto igual a 10 ºC e dados cgelo = 0,5 cal/(g·ºC); Lf = 80 cal/g; cágua = 1 cal/(g·ºC), pode-se afirmar que a quantidade de calor total recebida é igual a:
a) 20.000 cal
b) 16.000 cal
c) 4.000 cal
d) 19.000 cal
e) 2.000 cal
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!