Bora fazer a diferença e gabaritar nas questões de química. Domine a Constante de Equilíbrio para arrancar na frente da concorrência. Veja agora, com aulas gratuitas.
A constante de equilíbrio é um valor que relaciona as concentrações das espécies reagentes e do produto no momento em que ocorre o equilíbrio.
O Kc representa o valor das constantes de equilíbrio em uma temperatura determinada , em função da concentração da espécies em mol L -1 ou [ ] mol L-1 . Em caso da ocorrência da reação em fase gasosa, a constante é comumente expressa Kp, em função das pressões parciais das espécies presentes no equilíbrio.
Resumo sobre Constante de Equilíbrio
Veja agora com a professora de química Larissa Campos, do canal do Curso Enem Gratuito, uma introdução descomplicada sobre Constante de Equilíbrio:
Observe a reação genérica abaixo:
![]()
A constante de equilíbrio é dada por:

Fique ligado!
Cada concentração, na expressão da constante de equilíbrio, é elevada a um expoente correspondente ao coeficiente da respectiva substância na reação.
E outro detalhe muito importante: O Kc não apresenta nenhuma unidade.
Veja o exemplo da formação do trióxido de enxofre (SO3) a partir do gás oxigênio (O2) e do dióxido de enxofre (SO2(g)) que é uma etapa do processo de fabricação do ácido sulfúrico.
A constante de equilíbrio desta reação é dada por:
Equilíbrio
2SO2(g) + O2(g) ⇌ 2SO3(g)
2SO3(g) ⇌ 2SO2(g) + O2(g)
Constante de equilíbrio
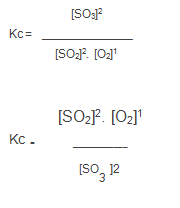
Saiba mais sobre a constante de equilíbrio com o professor Sobis, do Curso Enem Gratuito e mande bem nesse assunto! Vamos nessa!
Um aspecto muito importante na expressão da constante de equilíbrio, é que não devem ser representados componentes sólidos e nem líquidos puros, pois somente as matérias que podem sofrer variação é que participam da expressão.
Entendeu? Então observe esse exemplo:
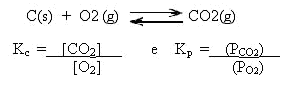
Veja que o C(s) não entra na expressão da constante de equilíbrio!
Os valores de Kc podem nos mostrar se a concentração dos reagentes e dos produtos são iguais ou se uma é maior do que a outra. Preste atenção:
- Se Kc ou Kp for igual a um (Kc = 1), isso significa que a concentração dos reagentes e produtos são iguais.
- Se Kc ou Kp for alto, isso significa que os produtos estão em maior concentração pois na expressão do Kc os produtos estão no numerador.
- Se Kc ou Kp for baixo, isso significa que os reagentes estão em maior concentração, pois na expressão de Kc os reagentes estão no denominador.
Dica 1 – Saiba mais sobre equilíbrio químico acessando o nosso Blog do Enem e conferindo um super-resumo que preparamos especialmente para você!
Quer saber mais sobre a constante de equilíbrio e mandar bem nas provas do Enem e dos vestibulares? Então assista a vídeo aula da Khan Academy, traduzido para o Português pela Fundação Lemann, onde o professor Salman Khan explica tudo sobre esse assunto.
Agora um desafio sobre constante de equilíbrio para você! Não deixe de fazer!
(UFU – MG) Misturam-se 2 mols de ácido acético com 3 mols de álcool etílico, a 25°C, e espera-se atingir o equilíbrio. Sendo o valor de Kc, a 25°C, igual a 4, as quantidades aproximadas, em mols, de ácido acético e acetato de etila são, respectivamente:
a) 2 e 5
b) 2 e 3
c) 0,43 e 1,57
d) 3,57 e 1,57
e) 3,57 e 4,57
Resposta: C


