O calor é transferido espontaneamente de um corpo “mais quente” para o “mais frio”. Confira o resumo sobre Princípios de Trocas de Calor nesta aula de Física Enem.
O Princípio Geral das Trocas de Calor – De acordo com o que você já estudou (lembra?), calor é uma forma de energia que se transfere de um corpo para outro devido a uma diferença de temperaturas entre eles.
O calor sempre flui espontaneamente do corpo “mais quente” para o corpo “mais frio”. As Trocas de Calor ocorrem neste fluxo.
Na Física, estudaremos ao longo do curso alguns princípios de conservação: a conservação da carga elétrica, a conservação da quantidade de movimento e a conservação da energia. Tudo a ver com as trocas de calor.
O princípio da conservação da energia estabelece que energia não pode ser criada e nem destruída, mas apenas convertida de um tipo em outro.
Veja uma introdução sobre as Transferências de Calor e o Equilíbrio Térmico:
Ajudou você a “refrescar” a memória?
Entende-se por sistema termicamente isolado (ou sistema adiabático) o sistema que não pode receber calor externo e tampouco rejeitar calor para o exterior. Ele estaria imune, portanto, para as Trocas de Calor.
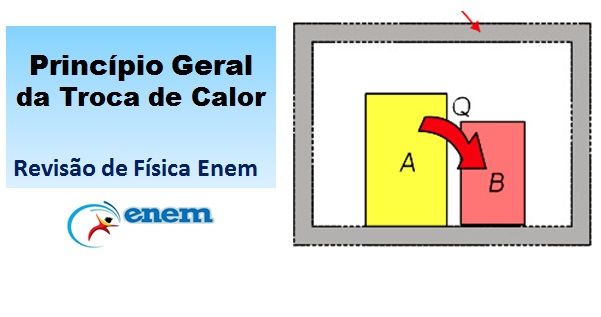
Consideremos, então, um sistema termicamente isolado constituído por dois corpos, A e B, a temperaturas diferentes, com θA > θB.
Nesse caso, podemos considerar que os corpos A e B estão, por exemplo, no interior de uma caixa de isopor e que calor não pode atravessar as paredes desta caixa.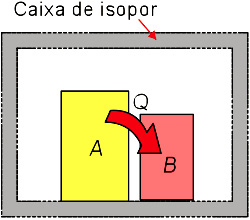 Nesse caso, todo o calor recebido por B só pode ter sido cedido por A. Então: QA + QB = 0
Nesse caso, todo o calor recebido por B só pode ter sido cedido por A. Então: QA + QB = 0
O que consideramos para os corpos A e B vale também quando mais de dois corpos realizam Trocas de Calor. Assim se constitui o princípio geral das trocas de calor.
Assim, podemos enunciar o princípio geral das trocas de calor:
Quando dois ou mais corpos trocam calor entre si, em um sistema termicamente isolado, até ser atingido o equilíbrio térmico, a soma algébrica das quantidades de calor trocadas é nula.
Escrevemos, então:
|
Q1 + Q2 + Q3 + Q4 + … + Qn = 0 |
O sinal da quantidade de calor Q
A partir da expressão que fornece a quantidade de calor sensível, Q = m · c · Δθ, podemos concluir que o sinal (positivo ou negativo) da quantidade de calor Q depende apenas do sinal da variação de temperatura Δθ, pois m e c são grandezas físicas sempre positivas.
Assim, quando a temperatura do corpo aumenta (Δθ > 0) a quantidade de calor Q terá sinal positivo. Ou seja, calor recebido é positivo.
Por outro lado, quando a temperatura do corpo diminui (Δθ < 0) a quantidade de calor Q terá sinal negativo. Ou seja, calor perdido (ou rejeitado) é negativo.
Nesta aula vamos nos limitar a estudar as trocas de calor que provocam apenas variações de temperaturas nos corpos e não alterações em seus estados físicos.
Resumo da 1a Lei da 1ª Lei da Termodinâmica
Muito boa esta aula. Agora, vamos retornar para as Trocas de Calor:
Consideremos uma aplicação numérica simples para melhor entendermos como aplicar o princípio das trocas de calor a uma situação cotidiana.
Exercício de Aplicação numérica
Uma mãe, ao preparar o banho do bebê, pretende encher uma banheirinha com 30 L de água à temperatura de 35 °C. Para isso irá misturar água da torneira a 20 °C com água fervente a 100 °C. Quantos litros de água fervente e quantos litros de água da torneira deverão ser usados? Considere que a densidade da água é de 1 kg/L.
Resolução
Vamos chamar de M1 a massa de água quente, a 100 °C, e de M2 a massa de água fria, a 20 °C, que serão usadas.
Note que:
M1 + M2 = 30 kg (I)
A água quente irá perder calor, dado por:
Q1 = M1 · c · (35 – 100)→ Q1 = – 65 · M1 · c
A água fria irá receber calor, dado por:
Q2 = M2 · c · (35 – 20)→ Q2 = 15 · M2 · c
De acordo com o princípio geral das trocas de calor (Q1 + Q2 = 0), teremos:
– 65 · M1 · c + 15 · M2 · c = 0→
15 · M2 = 65 · M1→
3 · M2 = 13 · M1→
M2 = 4,33 · M1(II)
Substituindo a equação (II) na equação (I), obtemos:
M1 + 4,33 · M1 = 30→
5,33 · M1 = 30→
M1 = 6,9 kg
Logo:
6,9 + M2 = 30→
M2 = 23,1 kg
Portanto, a mãe deverá usar, aproximadamente, 6,9 L de água fervente e 23,1 L de água da torneira.
Dica 1 – Relembre sobre Calor sensível e Calor latente nesta aula de Física Enem. Estude conosco e fique preparado para o Exame Nacional do Ensino Médio! – https://blogdoenem.com.br/calor-sensivel-e-calor-latente-revisao-de-fisica-enem/
Dica 2 – Nesta aula de Física Enem vamos estudar sobre a Dilatação Térmica dos Líquidos e saber por que a água, ao ser aquecida, não reage como os outros líquidos – https://blogdoenem.com.br/dilatacao-termica-dos-liquidos-fisica-enem/
Dica 3 – Fique pronto para o Exame Nacional do Ensino médio revisando sobre Dilatação Térmica do Sólidos nesta aula de Física Enem – https://blogdoenem.com.br/dilatacao-termica-dos-solidos-revisao-fisica-enem/
Desafios para você resolver e compartilhar as soluções
Questão 1
(PUC – RJ) Uma quantidade m de água a 90 °C é misturada a 1,0 kg de água a 30 °C. O resultado final em equilíbrio está a 45 °C. A quantidade m, em kg, vale:
- a) 1,00.
- b) 2,00.
- c) 0,66.
- d) 0,33.
- e) 3,00.
Questão 2
(VUNESP–SP) Uma cozinheira, moradora de uma cidade praiana, não dispunha de um termômetro e necessitava obter água a uma temperatura de 60 ºC. Resolveu, então, misturar água fervendo com água proveniente de um pedaço de gelo que estava derretendo.
Considere o sistema isolado, ou seja, que a troca de calor só se estabeleceu entre as quantidades de água misturadas e, ainda, que a cozinheira usou a mesma xícara nas suas medições. A cozinheira só chegaria ao seu objetivo se tivesse misturado uma xícara da água a 0 ºC com
- a) três xícaras de água fervendo.
- b) duas xícaras e meia de água fervendo.
- c) duas xícaras de água fervendo.
- d) uma xícara e meia de água fervendo.
- e) meia xícara de água fervendo.
Questão 3
(UFPR) Uma montanhista utiliza em suas escaladas uma caneca com massa igual a 100 g e feita de um material com calor específico de 910 J/(kg·ºC). Num certo momento, ela coloca 200 g de chá à temperatura inicial de 80 ºC em sua caneca, que se encontra à temperatura ambiente de 10 ºC. Despreze a troca de calor com o ambiente e considere que o calor específico do chá é igual ao da água, isto é, 1,0 cal/(g·ºC). Determine a temperatura do chá após o sistema ter atingido o equilíbrio térmico.
- a) 78 °C
- b) 73 °C
- c) 63 °C
- d) 58 °C
- e) 45 °C
Questão 4
(UFC) Três recipientes A, B e C contêm, respectivamente, massas m, m/2 e m/4 de um mesmo líquido. No recipiente A, o líquido encontra-se a uma temperatura T; no recipiente B, a uma temperatura T/2; no recipiente C, a uma temperatura T/4. Os três líquidos são misturados, sem que haja perda de calor, atingindo uma temperatura final de equilíbrio Tf . Assinale a alternativa que contém o valor correto de Tf .
- a) T/2.
- b) 3·T/4.
- c) 3·T/8.
- d) 5·T/16.
- e) 2·T/3.
Questão 5
(PUC – RJ) Um calorímetro isolado termicamente possui, inicialmente, 1,0 kg de água a uma temperatura de 55 °C. Adicionamos, então, 500 g de água a 25 °C. Dado que o calor especifico da água é 1,0 cal/(g · °C), que o calor latente de fusão é 80 cal/g e que sua densidade é 1,0 g/cm3, calcule:
- a) a temperatura de equilíbrio da água;
- b) a energia (em calorias – cal) que deve ser fornecida à água na situação do item a) para que esta atinja a temperatura de ebulição de 100 °C.
- c) quanto calor deve ser retirado do calorímetro, no item b), para que toda a água fique congelada.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!