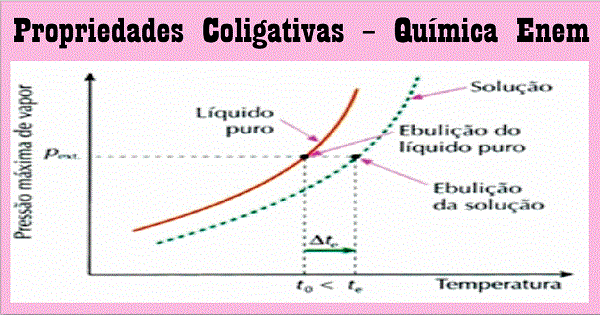
Por que a água ferve mais rápido em locais de elevada altitude? Essa e outras perguntas podem ser respondidas através do estudo das propriedades coligativas. Você lembra desse assunto?
O que são as propriedades coligativas? São aquelas propriedades das substâncias puras que são modificadas quando se adiciona um soluto não volátil a elas.
Essas propriedades, portanto, não são explicadas pela natureza da substância, mas sim pela quantidade de suas moléculas, partículas ou átomos. São as alterações que os solutos causam ao solvente.
Dica 1– O que mais cai em Química nos Vestibulares no Enem? Veja aqui as melhores dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Existem quatro propriedades coligativas que são:
- Diminuição da pressão de vapor, chamada de tonoscopia;
- Aumento do ponto de ebulição, chamada de ebuloscopia;
- Diminuição do ponto de congelamento, chamada de crioscopia;
- Aumento da pressão osmótica, chamada de osmose.
Dica 2– Você acha difícil memorizar tudo que aprende? O Blog do Enem pode te ajudar! Acesse o link e descubra quais as dicas para você memorizar o que estudou. https://www.alunosonline.com.br/portugues/dicas-para-voce-memorizar-o-que-estuda.html
Que estudar essas quatro propriedades? Vamos nessa…
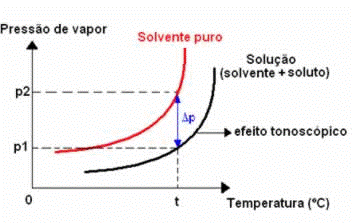
Tonoscopia ou Tonometria é o estudo do abaixamento da pressão máxima de vapor de um líquido, que é ocasionado pela dissolução de um soluto não volátil.
Quando se dissolve um soluto não volátil em um líquido, observa-se que os valores da pressão máxima de vapor do líquido diminuem, em relação ao líquido puro, ou seja, a curva correspondente à solução ficará “rebaixada” em relação à do líquido puro.
Ebuliometria ou Ebuloscopia é o estudo da elevação da temperatura de ebulição de um líquido, ocasionada pela dissolução de um soluto não volátil.
Quando se dissolve um soluto não volátil em um líquido, observa-se que a temperatura de ebulição do líquido aumenta. Esse fato é consequência do abaixamento da pressão máxima dos vapores, como vimos acima.
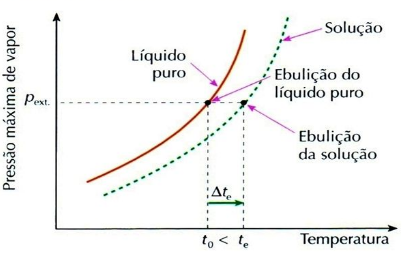
Note que à medida que a solução ferve, o solvente vai evaporando, a concentração da solução vai aumentando e sua temperatura de ebulição (te) também aumenta.
Dica 3 – Reveja também outro assunto bastante cobrado nas provas do Enem e dos vestibulares que é Haletos orgânicos. Acesse o nosso blog do Enem e confira. Vai ficar de fora dessa? https://blogdoenem.com.br/haletos-organicos-quimica-enem/
Criometria ou Crioscopia é o estudo do abaixamento da temperatura de congelação de um líquido, provocado pela dissolução de um soluto não volátil.
Quando se compara um solvente puro e uma solução de soluto não volátil, é possível afirmar que o ponto de congelamento da solução sempre será menor que o ponto de congelamento do solvente puro. Uma observação importante é que, quanto maior o número de partículas dissolvidas em uma solução, menor será o seu ponto de congelamento.
Osmometria é o estudo e a medição da pressão osmótica (pressão exercida sobre a solução para impedir sua diluição pela passagem do solvente puro através de uma membrana semipermeável) das soluções.
Leis da Osmometria
• Primeira Lei da Osmometria: Em temperatura constante, a pressão osmótica é diretamente proporcional à molaridade da solução.
Em particular, para um número fixo (n1) de mols do soluto, a pressão osmótica será inversamente proporcional ao volume da solução.
• Segunda Lei da Osmometria: Em molaridade constante, a pressão osmótica é diretamente proporcional à temperatura absoluta da solução.
Gostou? Quer aprender mais sobre as propriedades coligativas? Então assista a vídeo aula do professor Ruffini do Aulalivre.net e fique fera. Não deixe de conferir!
Dica 4 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.
Você consegue resolver este exercício? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!
(UEG GO 2015) As propriedades físicas dos líquidos podem ser comparadas a partir de um gráfico de pressão de vapor em função da temperatura, como mostrado no gráfico hipotético a seguir para as substâncias A, B, C e D.
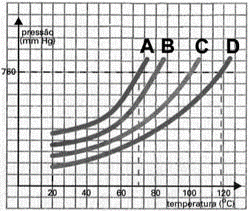
Segundo o gráfico, o líquido mais volátil será a substância:
a) A
b) B
c) C
d) D