Confira a Lei de Proust que definiu as Proporções Constantes nos reagentes químicos. Aula gratuita para sua revisão do Enem e do Vestibular.
É hora de relembrar uma lei muito importante nas reações químicas. É isso mesmo, estamos falando da Lei de Proust! Cai nas provas dos vestibulares e no Enem também. Vamos lá: comece observando com calma a imagem a seguir. Ela diz muito sobre as Proporções Constantes. Em seguida, veja a aula completa.
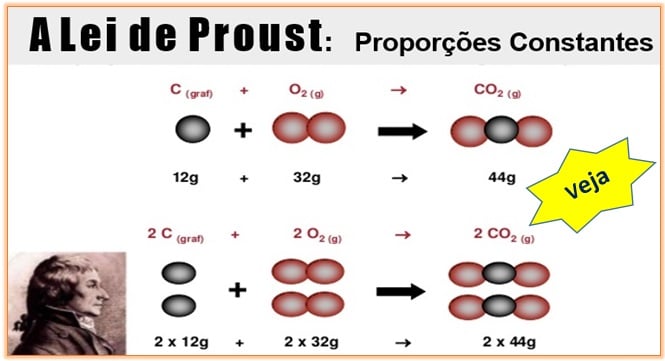
A Lei de Proust, também denominada Lei das Proporções Constantes ou Definidas, foi criada pelo químico francês Joseph Louis Proust (1754-1826) e diz que uma determinada substância composta é formada por substâncias mais simples, unidas sempre na mesma proporção em massa.
Através de análises de inúmeras substâncias adquiridas por diferentes processos foi possível verificar que uma mesma substância tem sempre a mesma composição qualitativa e quantitativa. Por exemplo, qualquer amostra de água apresenta sempre 11,1 % em massa de hidrogênio e 88,9 % de oxigênio combinados na mesma proporção, ou seja, 1:8, respectivamente.
Veja como ocorrem as Proporções Constantes:
A definição da Lei de Proust você já viu logo no começo desta aula. Agora é hora de sair da teoria e ir para a prática. Assim você aprende melhor e não esquece mais. Confira no quadro a seguir e veja se você decifra como as proporções se mantêm:
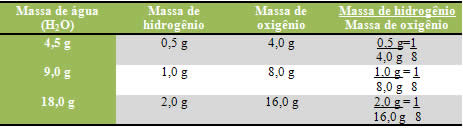
Observe que não importa a quantidade de massa dos elementos usada, a proporção sempre será a mesma! Esta foi a grande descoberta que gerou a Lei de Proust, a Lei das Proporções Constantes.
A lei de Proust e a Lei de Lavoisier (Na natureza nada se cria, nada se perde, tudo se transforma) são denominadas Leis Ponderais, porque falam em massas das substâncias envolvidas.
Lembra-se da lei de Lavoisier? Que tal relembrar com o prof. Sobis do Curso Enem Gratuito?

Veja agora um exemplo sobre a Lei de Proust
Sabe-se que 28 g de nitrogênio reagem completamente com 6 g de hidrogênio, formando amônia. Qual será a massa, em gramas de amônia formada, quando 140 g de nitrogênio reagir com hidrogênio suficiente para completar a reação?
Resolução:
Utilizando a Lei de Lavoisier, sabemos que a massa dos produtos é igual à soma das massas dos reagentes, assim, temos:

x = 28 g + 6g = 34 g
Agora utilizaremos a Lei de Proust, que nos diz que a proporção das massas dos reagentes e dos produtos deve ser mantida constante. Assim, se a massa do nitrogênio passou de 28 g para 140 g, quer dizer que ela aumentou 5 vezes, por isso, as outras massas também terão que aumentar 5 vezes:

Portanto a massa da amônia formada nesse caso é 170 g.
Dica 1 – Você acha difícil memorizar tudo que aprende? O Blog do Enem te da a dica, acesse o link e descubra quais as dicas para você memorizar o que estudou. Aproveite! http://www.alunosonline.com.br/portugues/dicas-para-voce-memorizar-o-que-estuda.html
Agora é a sua vez! Vamos lá! Um desafio para você!
(UEL-PR) 46,0 g de sódio reagem com 32,0 goxigênio formando peróxido de sódio. Quantos gramas de sódio serão necessários para obter 156 g de peróxido de sódio?
a) 23,0
b) 32,0
c) 69,0
d) 78,0
e) 92,0Resposta: E
Dica 2 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.
Os textos e exemplos de apresentação desta revisão sobre Lei de Proust foram preparados pela professora Munique Dias para o Blog do Enem. Munique é formada em química pela UFSC, tem mestrado e doutorado em Engenharia Química, também pela UFSC. Facebook: https://www.facebook.com/Munique .




