Veja no resumo com aula gratuita sobre o Diagrama de Fases a explicação sobre como é possível patinar no gelo. É Química para você mandar bem no Enem
Você vê e quase não acredita que é verdade. Mas é pela ciência química que você consegue entender como funciona a Patinação no Gelo. Tudo a ver com o Diagrama de Fases. A fase na qual uma substância se apresenta depende de suas condições de pressão e temperatura.
Desta forma, para cada substância dizemos que há pares de valores dessas duas variáveis que correspondem à fase sólida, pares que correspondem à fase líquida e par que corresponde à fase gasosa.
Caso os possíveis pares de valores sejam lançados em um diagrama cartesiano, no qual se coloca em ordenadas (eixo x) a pressão e em abscissas (eixo y) a temperatura, obteremos, para um dado volume da amostra da substância, o diagrama de fases da substância.
Diagrama de fases: É um gráfico de pressão de uma substância em função de sua temperatura.
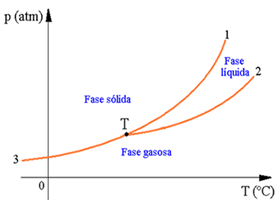 É um modo simples de expressar como a pressão e a temperatura influenciam nas mudanças de fase de uma substância química. Diagrama de fases de uma substância
É um modo simples de expressar como a pressão e a temperatura influenciam nas mudanças de fase de uma substância química. Diagrama de fases de uma substância
Veja como funciona…
curva de fusão(curva 1) limita as regiões das fases sólida e líquida;
curva de vaporização (curva 2): limita as regiões das fases líquida e gasosa;
curva de sublimação (curva de 3 até T): limita as regiões das fases sólida e gasosa.
O ponto T: É um ponto comum às três curvas e é denominado ponto triplo ou ponto tríplice, neste ponto as três fases – sólido líquido e gasoso, estão em equilíbrio.
Quer mandar bem nas provas do Enem e dos vestibulares? Assista agora uma super videoaula do Curso Enem Gratuito. É simples e rápida para você entender:
Vamos conhecer o diagrama de fases de uma das substâncias bastante conhecida por todos? É isso ai, estamos falando da água…
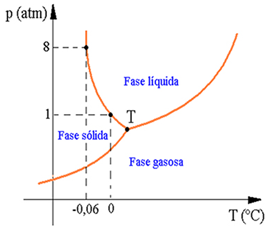
Diagrama de fases da água
Algumas substâncias ditas anômalas fogem da regra que quanto mais alta for a pressão exercida sobre uma substância, maior será a temperatura de mudança de fase, sendo ela fusão, solidificação ou sublimação.
Para essas substâncias tal regra não se aplica, pois quanto maior for a pressão sobre elas, mais baixa passa a ser a temperatura de fusão.
Sendo assim, o diagrama de fases da água é representado da seguinte maneira:
Diagrama de fases da água
Podemos observar no diagrama acima que quando a pressão é 1 atmosfera, a fusão do gelo se dá a uma temperatura de 0 ºC. Entretanto, quando a pressão exercida é de 8 atmosferas, o gelo se funde a uma temperatura mais baixa, cerca de -0,06 ºC.
Se você observar o diagrama da água e compará-lo com o de outra substância, perceberá que a linha delimitadora entre as fases sólidas e líquidas apresenta uma inclinação para esquerda.
Mas o que quer dizer essa inclinação?
Ela quer dizer que é possível fundir a água por meio de um simples aumento de pressão.
Ahhh agora sim! É por isso que podemos patinar no gelo?
É isso mesmo! Quando os patins deslizam sobre o gelo, a pressão exercida pela lâmina na superfície faz o gelo derreter Portanto, na realidade os patins deslizam sobre uma fina película de água líquida, e não sobre a água sólida.
Portanto, na realidade os patins deslizam sobre uma fina película de água líquida, e não sobre a água sólida.
Agora, veja um exercício resolvido sobre Diagrama de Fase:
Dica 2– Complemente seus estudos acessando o nosso Blog do Enem e conferindo um super-resumo preparado especialmente para você sobre as reações de neutralização. Não deixe de estudar! https://blogdoenem.com.br/quimica-reacao-neutralizacao-2/
E ai? Deu para relembrar sobre diagrama de fases? Vamos testar? Que tal resolver um desafio?
(UFF – RJ) Marque a opção que apresenta a afirmativa falsa:
a) Uma substância não existe na fase líquida quando submetida a pressões abaixo daquela do seu ponto triplo.
b) A sublimação de uma substância é possível se esta estiver submetida a pressões mais baixas que a de seu ponto triplo.
c) Uma substância só pode existir na fase líquida se a temperatura a que estiver submetida for mais elevada que sua temperatura crítica.
d) Uma substância não sofre condensação a temperaturas mais elevadas que sua temperatura crítica
e) Na Lua, um bloco de gelo pode passar diretamente para a fase gasosa.
Resposta: C
Dica 3 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.