Confira Ponto de Fusão e Ponto de Ebulição; Solubilidade em Água; Resistência ao Aquecimento; Condutividade e outras características essenciais dos Compostos Orgânicos. É conteúdo de Química Orgânica para o Enem, o Encceja e os vestibulares. Veja o resumo gratuito.
Hora de cair na real e ver o resumo sobre as características gerais dos compostos orgânicos. É um dos assuntos mais quentes para as questões de Química no Enem, Encceja e nos vestibulares. Veja as principais características.
Os compostos orgânicos podem ser analisados em diversas propriedades para fins de comparação entre as substâncias. Os critérios básicos de identificação e classificação das características são:
- Composição;
- Combustibilidade;
- Temperatura de Fusão;
- Temperatura de Ebulição;
- Densidade;
- Condutividade Elétrica;
- Solubilidade;
- Velocidade das Reações;
- Resistência ao Aquecimento;
- Isomeria e Polimeria
Veja as temperaturas de fusão e de ebulição
À temperatura ambiente, podemos encontrar os compostos orgânicos em três estados físicos: sólido, líquido e gasoso. Isso prova que seus pontos de fusão e ebulição são menores do que em substâncias de origem inorgânica, uma vez que a maioria dos compostos inorgânicos se encontra no estado sólido. Sólido; Líquido; e Gasolo – Os Três Estados da Matéria. Em todos eles podemos encontrar os compostos orgânicos
Sólido; Líquido; e Gasolo – Os Três Estados da Matéria. Em todos eles podemos encontrar os compostos orgânicos
As propriedades de um material ou substância dependem de seu conjunto de características. Para facilitar seu trabalho, os químicos observam o comportamento variando uma característica de cada vez. Para começar, vamos rever As Escalas Termométricas.
Aula Gratuita: Temperaturas de Fusão e Ebulição
Confira um resumo simples e rápido do Curso Enem Gratuito para você entender as temperaturas de fusão e de ebulição nas escalas de graus Célsius; Kelvin, e Fahrenheit.
Muito bom este resumo. Agora, vamos continuar.
Veja como varia a temperatura de fusão e ebulição de uma substância em função da massa molar.
Lembre-se de que à medida que aumenta o número de átomos da cadeia, os pontos de fusão e ebulição também aumentam. A variação do ponto de fusão e de ebulição com a massa molar, não é uma característica somente dos alcanos, ela se aplica a todas as outras funções orgânicas. Pois na verdade, isso é uma característica geral dos compostos orgânicos!
O principal responsável pelas propriedades das substâncias orgânicas como o ponto de fusão e ebulição, é a natureza das forças intermoleculares, a qual está relacionada com a organização da molécula e com os seus grupos funcionais.
Aula gratuita: As Características dos Compostos Orgânicos
Agora veja um resumo bem direto sobre as características das Funções Orgânicas. Em seguida veja como a temperatura de Fusão e de Ebulição varia de acordo com a composição de cada Composto Orgânico.
Veja agora os detalhes da Combustibilidade, Polaridade, Solubilidade, e Ponto de Fusão e de Ebulição
Combustibilidade: é a propriedade que um composto tem de se queimar. A maioria das substâncias que sofrem combustão é de origem orgânica. É por isso que dizemos que compostos orgânicos são ótimos combustíveis.
- Exemplos:
– O gás que utilizamos na cozinha (GLP) é composto por hidrocarbonetos, portanto é orgânico. - – O álcool combustível dos automóveis – etanol de fórmula (CH3CH2OH) – é de origem orgânica.
Dica Enem 02: Pérolas do Enem – Vocês não aparecerão por aqui, combinado? https://blogdoenem.com.br/perolas-do-enem-voces/
Temperatura de fusão e de ebulição: À temperatura ambiente, os compostos orgânicos se encontram nos três estados físicos: sólido, líquido e gasoso.
Isso prova que seus pontos de fusão e ebulição são menores do que em substâncias de origem inorgânica, uma vez que a maioria dos compostos inorgânicos se encontra no estado sólido. Compostos de origem orgânica apresentam interações intermoleculares mais fracas e por isso têm temperatura de ebulição e fusão mais baixas.
Compostos de origem orgânica apresentam interações intermoleculares mais fracas e por isso têm temperatura de ebulição e fusão mais baixas.
- Exemplos:
- – Gás butano (C4H10): o gás usado em isqueiros tem temperaturas de fusão (-138 °C) e ebulição (0 °C) baixas.
- – Etanol: líquido combustível com temperatura de fusão (-117 °C) e ebulição (78,3 °C).
- Compare agora esses valores com a temperatura de fusão (T.F) e ebulição (T.E.) de um composto inorgânico sólido, o sal de cozinha (Cloreto de Sódio -NaCl).
- T. F do sal: 801 °C
T.E. do sal: 1413 °C - Como vemos, o sal inorgânico usado em nossa alimentação possui temperaturas de fusão e ebulição bem acima da T.F e T.E. dos compostos orgânicos.
Dica Enem 03: Tudo sobre apostilas gratuitas para o Enem https://blogdoenem.com.br/category/apostila-enem/
Polaridade: As ligações mais freqüentes envolvendo compostos orgânicos acontecem entre átomos de carbono ou entre átomos de carbono e hidrogênio.
Todas as ligações dos compostos orgânicos formados somente por carbono e hidrogênio são apolares, pois os átomos unidos demonstram uma pequena desigualdade de eletronegatividade. Quando na molécula de um composto orgânico, houver outro elemento químico além de carbono e hidrogênio, suas moléculas passarão a apresentar certa polaridade.
Quando na molécula de um composto orgânico, houver outro elemento químico além de carbono e hidrogênio, suas moléculas passarão a apresentar certa polaridade.
Solubilidade em água: Essa propriedade se relaciona com a polaridade da molécula orgânica. Compostos orgânicos apolares: são praticamente todos insolúveis em água. Seguindo a regra:“Semelhante dissolve semelhante”, vemos a razão.
Como a água é polar, ela não dissolve compostos apolares como gasolina, querosene, óleo diesel, etc. Compostos orgânicos polares: esses podem ser dissolvidos na água. Exemplos: açúcar, álcool comum, acetona etc.
Compostos orgânicos polares: esses podem ser dissolvidos na água. Exemplos: açúcar, álcool comum, acetona etc.
Aula Gratuita: Veja o básico das Funções Orgânicas
Muito bom este resumo do professor Sobis. Bom aproveitamento.
Veja os Principais compostos orgânicos:
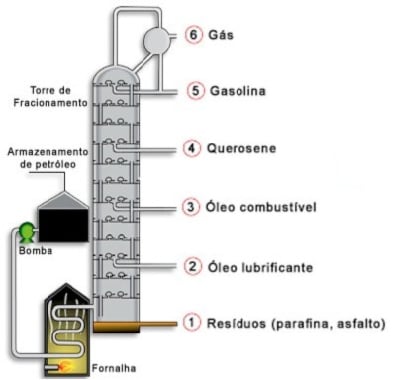
- Petróleo (composto natural) – é um líquido oleoso, escuro, formado por milhares de compostos orgânicos (principalmente hidrocarbonetos). Quanto mais hidrocarbonetos, mais fácil o refino do petróleo. Veja na imagem a Destilação Fracionada do Petróleo:

O Petróleo costuma ser dividido em:
- base parafínica – quando mais de 90% da composição é de alcanos.
- base asfáltica – quando predominam hidrocarbonetos de elevado ponto de ebulição (usados para fazer asfato).
- base naftalênica – quando 15% a 20% da composição é referente a cicloalcanos (hidrocarbonetos naftalênicos).
- base aromática – quando 25 a 30% da composição é referente a hidrocarbonetos aromáticos.
Gás natural – é uma mistura gasosa, formada por 70 a 90% de metano (CH4), 0,5 a 7% de etano (C2H6), outros hidrocarbonetos (propano e butano em pequenas quantidades) bem como contaminantes (H2S e CO2 (responsáveis pela corrosão de escapamentos de automóveis), N2, etc.).
Hulha ou carvão-de-pedra – é um carvão mineral, encontrado em geral entre 400 a 1000m de profundidade.
Dica do Blog > Quando aquecida a aproximadamente 1000ºC, a hulha produz 4 frações principais:
- Gás hulha – H2, CH4, CO- usado como fonte de gás hidrogênio ou como combustível.
- Águas amoniacais – NH4OH e seus sais, o qual quando reage com H2SO4 produz (NH4)2SO4 (usado em adubos).
- Alcatrão da hulha – benzeno e derivados, fenóis, compostos aromáticos policíclicos (naftaleno, antraceno, etc.), piche, etc.
- Carvão coque – carbono de alta pureza, usado como agente redutor em metalúrgicas.
Compostos Sintéticos a partir do Nafta:
– Na indústria petroquímica – a partir do craqueamento e outros processos, o nafta (fração do petróleo) é transformado em:
- Polietileno (polímero (plástico) usado em embalagens, brinquedos, etc.);
- Polipropileno (polímero usado em fitas, tapetes, etc.);
- Borrachas sintéticas (pneus, etc.);
- Corantes (tintas);
- Explosivos;
- Poliéster (tecidos, etc.).
– Indústria carboquímica – a partir da hulha ou do acetileno (química do acetileno) são obtidos diversos compostos sintéticos:
- Policloreto de vinila (PVC);
- Poliacetato de vinila (plástico PVA);
- Poliacrilonitrila (fios têxteis) – Orlon e crylon;
- Ácido acético;
- Cloropreno (borracha sintéticas);
- Solventes clorados (não inflamáveis) – dicloroetileno; tetracloroetano.
Os Compostos Inorgânicos:
Você já estudou acima que as substâncias químicas podem ser agrupadas entre orgânicas e inorgânicas. E, já acompanhou o resumo sobre os Compostos Orgânicos. Agora, para fixar bem: Os compostos Inorgânicos são aquelas substâncias que não contêm carbono em sua composição: Ácidos; Bases; e Óxidos.
Fonte: Brasil Escola. Mundo Educação.