Veja como Demócrito; Dalton; Thomson; Rutherford; e Niels Bohr contribuíram na Evolução dos Modelos Atômicos. Resumo com ilustrações e videoaulas completas:
É claro que você se lembra de bate-pronto o que é um átomo. Mas o Enem pede mais do que isso. As questões vão mais fundo, e comparam a evolução dos Modelos Atômicos e as mudanças na ciência sobre a Estrutura do Átomo. O estudo sobre os Modelos Atômicos começa naturalmente pela recuperação do que o Átomo: é a menor partícula capaz de identificar um elemento químico e participar de uma reação química.
Evolução dos Modelos Atômicos
Mas, para chegar a este conceito foram necessários milhares de anos. Tudo começa na Grécia, com Leucipo e Demócrito. Depois, vieram os modelos de Dalton; Thomson; Rutherford, e Niels Bohr.
Veja a origem do conceito de Átomo: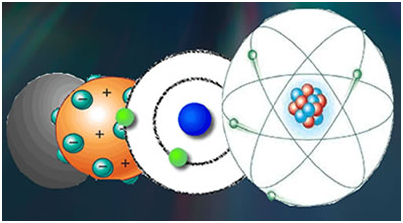
A origem do estudo do átomo está na Grécia antiga, com a proposição inicial do filósofo Leucipo e seu discípulo Demócrito: para eles, o átomo era o menor componente de toda a matéria existente. Sendo, então, impossível dividi-lo em partes menores, pensavam os gregos.
Ao desenrolar da história da ciência diversos cientistas e estudiosos tentaram definir o átomo quanto à sua forma, dando origem a diversas teorias sobre sua constituição física. Surgiram, então, diversos degraus na evolução dos Modelos Atômicos. Acompanhe cada um logo abaixo.
A sequência dos Modelos Atômicos
1 – Modelo de Dalton – Após as formulações iniciais dos gregos Leucipo e Demócrito vieram as contribuições de John Dalton, na Inglaterra, em 1808, destacando no ‘Modelo Dalton’ que a Matéria seria formada por partículas muito pequenas, os ‘átomos’; Estes átomos seriam esféricos, maciços, e indivisíveis; ![]() Os átomos com as mesmas propriedades seriam parte de um ‘elemento químico’; Os elementos diferentes, portanto, seriam formados por diferentes átomos; E, ainda, que as reações químicas seriam formas de unir, separar ou de rearranjar os átomos.
Os átomos com as mesmas propriedades seriam parte de um ‘elemento químico’; Os elementos diferentes, portanto, seriam formados por diferentes átomos; E, ainda, que as reações químicas seriam formas de unir, separar ou de rearranjar os átomos.
Resumo sobre o Modelo Atômico de John Dalton
Veja agora com o professor Felipe Sobis, um campeão de aulas de química na Internet, os detalhes da proposta de Dalton para a Estrutura do Átomo.
Mandou bem o professor Sobis. E você tem mais aulas dele no canal do Curso Enem Gratuito. Anota aí, e depois confere lá.
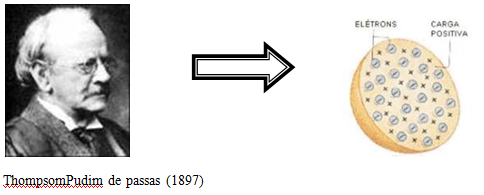
2 – O Modelo de Thomson
No final do século XIX o pesquisador inflês Joseph John Thomson derrubou a concepção de que o átomo era uma esfera indivisível, e que estava no modelo de Dalton. ![]() Para chegar a esta conclusão ele produziu um experimento om a emissão de raios catódicos, tendo como resultado a atração de partículas negativas em direção ao polo positivo de um campo elétrico externo. Ele batizou estas partículas de ‘elétrons’. Thomson sugeriu, então, o átomo esférico em equilíbrio elétrico, com cargas positivas e negativas.
Para chegar a esta conclusão ele produziu um experimento om a emissão de raios catódicos, tendo como resultado a atração de partículas negativas em direção ao polo positivo de um campo elétrico externo. Ele batizou estas partículas de ‘elétrons’. Thomson sugeriu, então, o átomo esférico em equilíbrio elétrico, com cargas positivas e negativas.
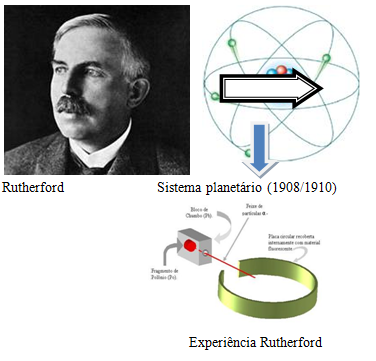
3 – O Modelo de Rutherford
No início do Século XX o neozelandês Ernest Rutherford derrubou os conceitos anteriores ao demonstrar através de um experimento de que o átomo não era ‘maciço’. Veja na aula do professor Sobis:
Rutherford bombardeou lâminas finíssimas de ouro com partículas alfa, e verificou que algumas passavam ‘direto’ e que outras eram desviadas. 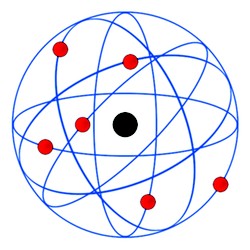 Assim, Rutherford deduziu que os átomos teriam um ‘núcleo’ mais consistente e de carga positiva, e que em torno dele orbitavam os elétrons em movimento circular, e de carga negativa (veja a imagem acima).
Assim, Rutherford deduziu que os átomos teriam um ‘núcleo’ mais consistente e de carga positiva, e que em torno dele orbitavam os elétrons em movimento circular, e de carga negativa (veja a imagem acima).
4 – O modelo Bohr-Rutherford
O novo Modelo Atômico
A– As diferentes orbitas circulares em torno do Núcleo consistiam-se em ‘camadas eletrônicas’, sendo cada uma delas com o seu próprio nível de energia. Ou seja, uma órbita tem diferente nível energia em relação às demais.
B- Quando os elétrons se movimentam numa mesma camada eletrônica eles não absorvem nem emitem energia espontaneamente.
C– Ao receber energia, o elétron pode saltar para outra órbita, mais energética. Dessa forma, o átomo fica instável, pois o elétron tende a voltar à sua orbita original. Quando o átomo volta à sua órbita original, ele devolve a energia que foi recebida em forma de luz ou calor. 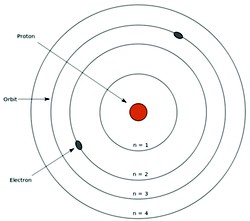 Veja na ilustração acima (fonte e imagem: Globo Educação).
Veja na ilustração acima (fonte e imagem: Globo Educação).
A História da Estrutura do Átomo
Que tal dar uma recapitulada de um modo rápido e fácil? Siga com a gente!
Átomo: Uma partícula indivisível.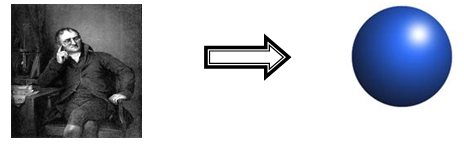
Esfera de carga elétrica positiva, não maciça;
O Sistema Planetário para o Modelo do Átomo, com Arthur Rutherford:
Niels Bohr e os níveis de energia:
Um Núcleo carregado positivamente e uma nuvem eletrônica carregada negativamente. Essa nuvem eletrônica é composta por elétrons que giram em órbitas elípticas ao redor do núcleo (assim como os planetas ao redor do sol). Os elétrons só se movem ao redor do núcleo quando estão alocados em certos níveis de energia. Dessa forma, um elétron só poderia mudar de nível de energia se ganhasse ou perdesse energia.
Os elétrons só se movem ao redor do núcleo quando estão alocados em certos níveis de energia. Dessa forma, um elétron só poderia mudar de nível de energia se ganhasse ou perdesse energia.
A Estrutura do Átomo
Confira aqui esta super aula de conclusão com o professor Felipe Sobis, para você dominar a atual Estrutura do Átomo:
Agora que você terminou a revisão básica, é hora de cair matando nos Exercícios
Exercícios sobre Os Modelos do Átomo
Você consegue resolver estes exercícios abaixo? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!
As afirmativas a seguir descrevem estudos sobre modelos atômicos, realizados por Niels Bohr, John Dalton e Ernest Rutherford.
- Partículas alfa foram desviadas de seu trajeto, devido à repulsão que o núcleo denso e a carga positiva do metal exerceram.
- Átomos (esferas indivisíveis e permanentes) de um elemento são idênticos em todas as suas propriedades. Átomos de elementos diferentes têm propriedades diferentes.
III. Os elétrons movem-se em órbitas, em torno do núcleo, sem perder ou ganhar energia.
Assinale a alternativa que indica a sequência correta do relacionamento desses estudos com seus autores.
- a) Rutherford, Dalton, Bohr
- b) Rutherford, Bohr, Dalton
- c) Dalton, Rutherford, Bohr
- d) Dalton, Bohr, Rutherford
Resposta: A




