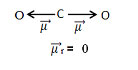Uma molécula polar é aquela que possui a sua nuvem de elétrons deslocada. Ou seja, os elétrons se encontram concentrados em uma parte da molécula, formando polos negativos. E, por consequência, formando polos positivos onde há o desfalque desses elétrons
Polar ou apolar? Veja como funciona esse assunto da Polaridade das Moléculas, que adora aparecer no Enem. Dicas com o professor Sobis, um show nas aulas de Química.
O essencial sobre as estruturas das moléculas é perceber que a forma como as moléculas se organizam no espaço influencia diretamente na polaridade.
Uma molécula polar é aquela que possui a sua nuvem de elétrons deslocada. Ou seja, os elétrons se encontram concentrados em uma parte da molécula, formando polos negativos.
E, por consequência, formando polos positivos onde há o desfalque desses elétrons. Veja o resumo inicial com o professor Sobis:
Ao analisarmos as estruturas das moléculas, podemos determinar se elas são polares ou não, levando em consideração dois fatores importantes: a diferença de eletronegatividade entre os átomos e a geometria da molécula.
- Uma molécula cujas ligações são todas apolares será apolar.
- Assim, as moléculas das substâncias simples são apolares.
- Leia novamente as duas frases acima, que elas são muito importantes.
- Agora, veja alguns exemplos: H2, F2, Cl2, O2, N2, P4, S8.
- Se a molécula for diatômica e formada por elementos de eletronegatividades diferentes, então, a molécula será polar. Exemplos: HCℓ, HF, HBr e HI.
Aula Gratuita sobre as Ligações Químicas
Veja com o professor Felipe Sobis, do Canal Curso Enem Gratuito, uma aula completa sobre as Ligações Químicas. Assim você fica em dia para as questões do Enem, do Encceja e dos Vestibulares. Confira:
Gostou do resumo com o professor Sobis? Ele é mesmo um fera.
A Geometria das Moléculas
– A geometria da molécula interfere em como os elétrons estarão distribuídos nela e, consequentemente, na sua polaridade. Se a molécula for formada por três átomos ou mais, teremos que analisar cada ligação que é feita e a geometria da molécula.
- Veja um exemplo: CO2 – molécula linear:
- δ– δ+ δ–
O = C = O - Observe que o oxigênio é mais eletronegativo que o carbono, por isso, os elétrons das ligações são mais atraídos para os oxigênios.
- Neles é formada uma carga parcial negativa (δ–), enquanto no carbono é formada uma carga parcial positiva (δ+).
A multiplicação da distância entre os núcleos dos átomos ligados com essas cargas em módulo (isto é, somente o número sem sinal de positivo ou negativo) é chamada de momento dipolar . A representação é esta: μ ![]()
- Esse momento dipolar é indicado por setas que apontam na direção do elemento mais eletronegativo, que atrai os elétrons: O ← C → O.
- Isso mostra que essa grandeza é um vetor (grandeza que apresenta módulo ou intensidade, direção e sentido).
- Portanto, ele é mais bem representado por:


Somando-se todos os vetores, encontramos o momento dipolar resultante, que nesse caso deu igual a zero porque os dois momentos dipolares possuem valores iguais, mas vão em direções opostas, anulando-se.
- Quando o vetor momento dipolar resultante der igual a zero, a molécula é apolar, mas quando der diferente de zero, ela será polar.
- Portanto, no caso da molécula de CO2, ela é apolar.
- Esse fenômeno influencia o ponto de ebulição das substâncias.
- E, agora você já consegue perceber que essa polaridade também influencia a solubilidade das substâncias.
- Dica para não esquecer: “Semelhante dissolve semelhante”.
- Ou seja, polar dissolve polar, e apolar dissolve apolar.”
Vai encarar o próximo Enem?
Então, aumente suas chances com as aulas e os simulados do Curso Enem Gratuito.