Você lembra-se o que é entalpia? E o qual a sua relação com as mudanças de estado físico da matéria? Que tal rever e mandar bem nas provas do ENEM e dos vestibulares?
Imaginemos um cubo de gelo à temperatura de -20 °C. Para que ele se liquefaça é necessário que seja fornecida energia na forma de calor ao sistema, ou seja, precisamos aquecê-lo.
Assim, a água líquida tem um conteúdo de energia, ou uma entalpia, maior que a água no estado sólido. O mesmo acontece se quisermos que a água que está no estado líquido, à temperatura ambiente, passe para o vapor; o sistema precisa absorver energia.
ENTALPIA
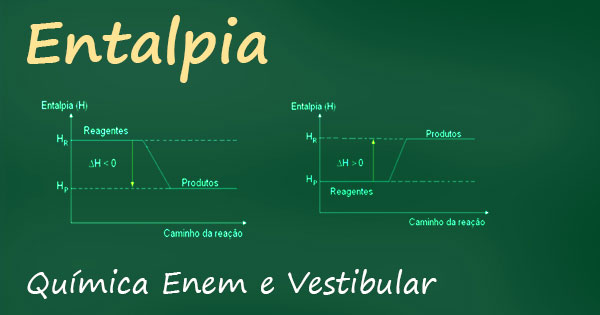
Entalpia é a quantidade de energia em uma determinada reação, podemos calcular o calor de um sistema através da variação de entalpia (∆H).
O ∆H NAS MUDANÇAS DE ESTADO FÍSICO:
Para que cada mudança de estado físico ocorra é necessário que haja absorção ou liberação de energia.


Você lembra o porquê do sinal de negativo e positivo no valor da entalpia? Vamos relembrar? Cai nas provas dos vestibulares e do Enem!
Quer entender melhor a entalpia? Veja a videoaula do Curso Enem Gratuito com o prof. Sobis!
PROCESSOS ENDOTÉRMICOS E EXOTÉRIMCOS
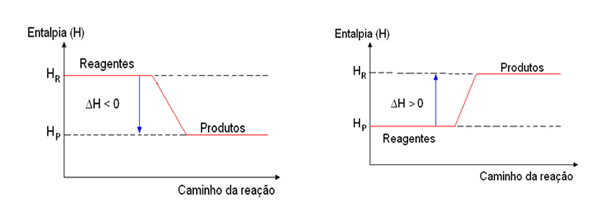
As reações químicas ou as mudanças de estado físico que liberam calor são processos chamados de exotérmicos. E os que ocorrem com absorção de calor são endotérmicos.
Processos exotérmicos Processos endotérmico
(o prefixo “exo” significa “para fora”) (o prefixo “endo” significa “para dentro”):

Reagentes → Produtos + calor Reagentes + calor → Produtos
Graficamente pode ser representado assim:
Dica 1 – O que mais cai em Química nos Vestibulares e no Enem
Dica 2 – Você acha difícil memorizar tudo que aprende? O Blog do Enem te da a dica, acesse o link e descubra quais as dicas para você memorizar o que estudou. Aproveite! http://www.alunosonline.com.br/portugues/dicas-para-voce-memorizar-o-que-estuda.html
Dica 3 – Veja dicas de revisão para o vestibular em 4 semanas! No site http://www.examtime.com.br/revisao-para-o-vestibular/
Gostou? Que tal rever mais alguns exemplos de processos exotérmicos e endotérmicos? É para ficar na mente! E não errar mais nas provas dos vestibulares e do Enem!
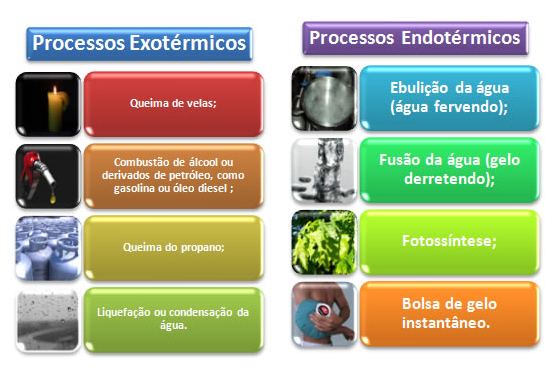
Vamos reforçar!
Aproveite essa chance!
Resumindo:

Dica 4 – Prepare-se para o vestibular resolvendo questões da Fuvest, Unicamp, Unesp e Enem. Acesse o site http://guiadoestudante.abril.com.br/estudar/jogos-multimidia/revisao-para-vestibular-647127.shtml, nele você pode montar a sua própria prova,colocando as matérias que mais tem dificuldade, testando o tempo que demora para resolver cada questão.
“Nunca avalie a altura de uma montanha até que atinja o cume. Quando atingir seu objetivo, verá então com a montanha era baixa.”
(Dag Hammarkjold – Ganhador do Prêmio Nobel da Paz de 1961)