Veja as características básicas e as propriedades dos gases. Entenda o que é um Gás Ideal, e aprenda a resolver questões de Transformações Gasosas, com mudanças de Volume, Temperatura e Pressão.
Os gases interagem com a vida na terra de diferentes maneiras. O oxigênio, por exemplo, está no ar na proporção de aproximadamente, 20% em volume, o ozônio encontrado na estratosfera é responsável pela absorção de parte significativa da radiação ultravioleta do sol. Veja revisão vestibular e Enem.
Você sabe o que são os gases? Vamos relembrar? Cai nos vestibulares e no Enem. Gases são compostos moleculares que possuem características como a grande compressibilidade e a capacidade de se expandirem, estes compostos não possuem volume fixo, são miscíveis entre si e em qualquer proporção.
Características básicas dos gases
Veja agora com o professor Felipe Sobis, do canal do Curso Enem Gratuito, as características e propriedades dos gases:
Os gases são substâncias cujas moléculas perdem totalmente a atração entre si e se dispersam muito umas das outras, além disso, estas moléculas estão sempre em movimento desordenado.
Este movimento faz com que algumas partículas se choquem quando estão confinadas em algum recipiente, e este choque gera o que chamamos de pressão que o gás exerce sobre determinadas superfícies.
Essas partículas estão em movimento constante entre si e com as paredes do recipiente que as contém.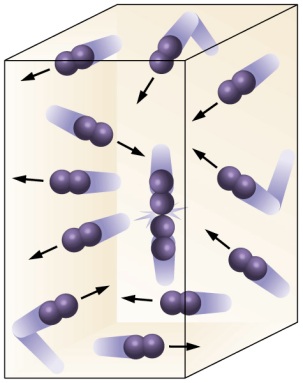
Você lembra-se da teoria cinética dos gases? Não se preocupe o blog do Enem ajuda você a relembrar, vem com a gente! Segundo a teoria cinética dos gases, a matéria, nesse estado, é formada de partículas (átomos ou moléculas) mais afastadas umas das outras do que no estado líquido ou sólido.
Veja o que é um gás ideal e as Transformações Gasosas
Resumo sobre o gás ideal
– No estudo dos gases adota-se um modelo teórico, simples e que na prática não existe, com comportamento aproximado ao dos gases reais.
Essa aproximação é cada vez melhor quanto menor for a pressão e maior a temperatura. Esse modelo de gás é denominado de gás perfeito ou ideal. É um gás que obedece às equações:
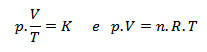
As partículas de um gás ideal apresentam as seguintes características:
- Têm volume considerado nulo em relação ao volume ocupado pelo gás;
- Chocam-se elasticamente, isto é, sem perda de energia cinética;
- Estão em constante e desordenado movimento;
- Não estão sujeitas a forças de atração ou repulsão.
Na prática, temos gases reais. Um gás real tende para o gás ideal quando a pressão tende a zero e a temperatura se eleva.
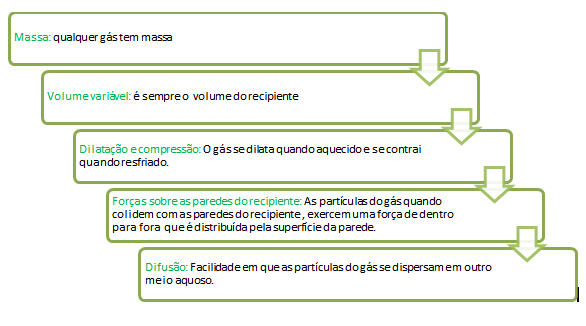
Os gases têm características importantes como:
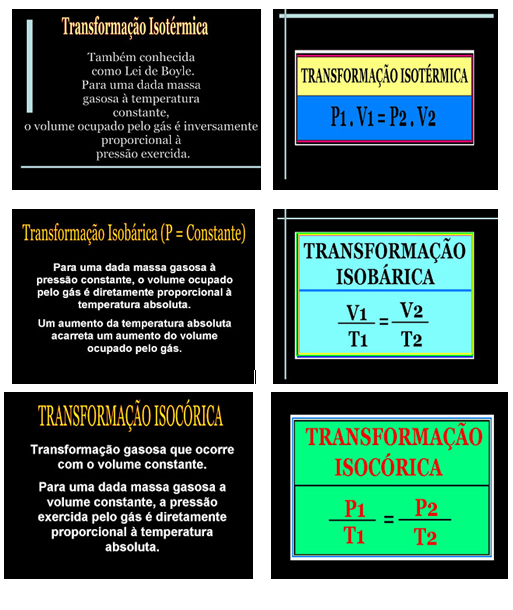
Transformações gasosas
Exercício Resolvido
Que tal praticar um pouco sobre gases? Vamos ver um exercício resolvido? É para mandar ver nas provas dos vestibulares e no próximo Enem.
Um recipiente a 28 0C contêm 80 litros de um certo gás exercendo a pressão de 1 atm. A pressão exercida por essa massa de gás a 28 0C em um recipiente com capacidade para 25 litros será?
a) 0,25 atm b)1,25 atm c)2,00 atm d)3,2 atm e) 4,00 atm
Resolução:
Como a transformação ocorre na mesma temperatura, temos uma transformação isotérmica, ou seja, com temperatura constante, então temos que: P 1.V 1 = P 2.V 2
Substituindo os valores dados no problema temos que:
- 80L.1atm = 25L.P 2
- P 2 = (80.1)/25
- P 2 = 3,2 atm
A Fórmula de Cálculo dos Gases:
Dica 1 – O que mais cai em Química nos Vestibulares e no Enem? Veja aqui as melhores dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Dica 2 – Você acha difícil memorizar tudo que aprende? O Blog do Enem te da a dica, acesse o link e descubra quais as dicas para você memorizar o que estudou. Aproveite! https://www.alunosonline.com.br/portugues/dicas-para-voce-memorizar-o-que-estuda.html
Agora um desafio para você!
Um recipiente contém 0,2 m 3 de um gás perfeito a 80 0C, suportando a pressão de 4000 mmHg. A temperatura do gás é aumentada até atingir 100 0C. Calcule a pressão final do gás.
Resposta: 2 mmHg
Dica 3 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.
“Acredite em si próprio e chegará um dia em que os outros não terão outra escolha senão acreditar com você”

Engenharia Química, também pela UFSC. Facebook: https://www.facebook.com/Munique .

