Veja desde a origem com Leucipo e Demócrito, e depois com os modelos de John Dalton; Thomson; Ernest Rutherford, e o modelo atômico de Niels Bohr. É pra gabaritar!
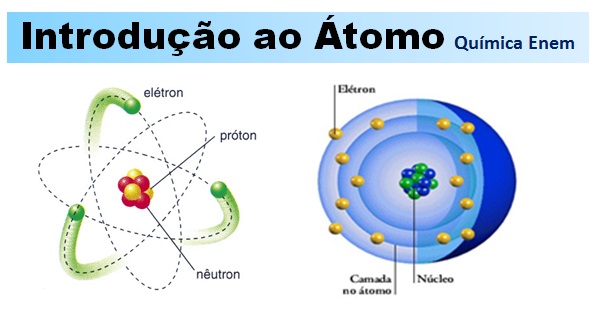
Você lembra o que é um átomo? Vamos relembrar? – O átomo é a menor partícula capaz de identificar um elemento químico e participar de uma reação química. Veja a estrutura atual de um Átomo antes de mergulhar na história dos modelos atômicos.
Os átomos são compostos de, pelo menos, um próton e um elétron. Podendo apresentar nêutrons (na verdade, apenas o hidrogênio não possui nêutron: é apenas um elétron girando em torno de um próton).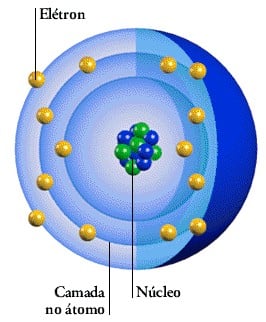
A Estrutura do Átomo
- Elétrons – Os elétrons são partículas de massa muito pequena (cerca de 1840 vezes menor que a massa do próton. Ou aproximadamente 9,1.10-28g) dotados de carga elétrica negativa: -1,6.10-19C. Movem-se muito rapidamente ao redor do núcleo atômico, gerando campos eletromagnéticos.
- Prótons – Os prótons são partículas que, junto aos nêutrons, formam o núcleo atômico. Possuem carga positiva de mesmo valor absoluto que a carga dos elétrons; assim, um próton e um elétron tendem a se atrair eletricamente.
- Nêutrons – Os nêutrons, junto aos prótons, formam o núcleo atômico. E, como possuem massa bastante parecida, perfazem 99,9% de toda a massa do átomo.
- Os Nêutrons possuem carga elétrica nula (resultante das subpartículas que os compõem), e são dispostos estrategicamente no núcleo de modo a estabilizá-lo: uma vez que dois prótons repelem-se mutuamente, a adição de um nêutron (princípio da fissão nuclear) causa instabilidade elétrica e o átomo se rompe.
As Camadas dos Elétrons
As Camadas dos Elétrons – Os elétrons estão dispostos em 8 camadas que constituem a eletrosfera. Para cada camada, determinado número de subníveis (orbitais) são preenchidos. A mais externa é chamada camada de valência, sendo também a mais energética.
O estudo sobre os Modelos Atômicos começa naturalmente pela recuperação do que o Átomo: é a menor partícula capaz de identificar um elemento químico e participar de uma reação química.
A história dos Modelos Atômicos
![]() Mas, para chegar a este conceito foram necessários milhares de anos. Tudo começa na Grécia, com Leucipo e Demócrito. Depois, vieram os modelos de Dalton; Thomson; Rutherford, e Niels Bohr.
Mas, para chegar a este conceito foram necessários milhares de anos. Tudo começa na Grécia, com Leucipo e Demócrito. Depois, vieram os modelos de Dalton; Thomson; Rutherford, e Niels Bohr.
A origem do estudo do átomo está na Grécia antiga, com a proposição inicial do filósofo Leucipo e seu discípulo Demócrito: para eles, o átomo era o menor componente de toda a matéria existente. Sendo, então, impossível dividi-lo em partes menores, pensavam os gregos. Este foi o primeiro capítulo da história dos modelos atômicos.
Como resolver questões de Modelos Atômicos
Confira agora com a professora Larissa Marques, do canal do Curso Enem Gratuito, as dicas básicas para você mandar bem nos exercícios de Modelos Atômicos.
Ao desenrolar da história da ciência diversos cientistas e estudiosos tentaram definir o átomo quanto à sua forma, dando origem a diversas teorias sobre sua constituição física. Surgiram, então, os Modelos Atômicos. Acompanhe cada um logo abaixo.
Evolução dos Modelos Atômicos
1 – Modelo de Dalton – Após as formulações iniciais dos gregos Leucipo e Demócrito vieram as contribuições de John Dalton, na Inglaterra, em 1808, destacando no ‘Modelo Dalton’ que a Matéria seria formada por partículas muito pequenas, os ‘átomos’; Estes átomos seriam esféricos, maciços, e indivisíveis; ![]() Os átomos com as mesmas propriedades seriam parte de um ‘elemento químico’; Os elementos diferentes, portanto, seriam formados por diferentes átomos; E, ainda, que as reações químicas seriam formas de unir, separar ou de rearranjar os átomos.
Os átomos com as mesmas propriedades seriam parte de um ‘elemento químico’; Os elementos diferentes, portanto, seriam formados por diferentes átomos; E, ainda, que as reações químicas seriam formas de unir, separar ou de rearranjar os átomos.
O Modelo Atômico de Dalton
Confira no resumo com o professor de química Felipe Sobis, do canal do Curso Enem Gratuito:
2 – Modelo de Thomson – No final do século XIX o pesquisador inflês Joseph John Thomson derrubou a concepção de que o átomo era uma esfera indivisível, e que estava no modelo de Dalton. ![]() Para chegar a esta conclusão ele produziu um experimento om a emissão de raios catódicos, tendo como resultado a atração de partículas negativas em direção ao polo positivo de um campo elétrico externo. Ele batizou estas partículas de ‘elétrons’. Thomson sugeriu, então, o átomo esférico em equilíbrio elétrico, com cargas positivas e negativas.
Para chegar a esta conclusão ele produziu um experimento om a emissão de raios catódicos, tendo como resultado a atração de partículas negativas em direção ao polo positivo de um campo elétrico externo. Ele batizou estas partículas de ‘elétrons’. Thomson sugeriu, então, o átomo esférico em equilíbrio elétrico, com cargas positivas e negativas.
Veja agora o Modelo Atômico de Thompson
.
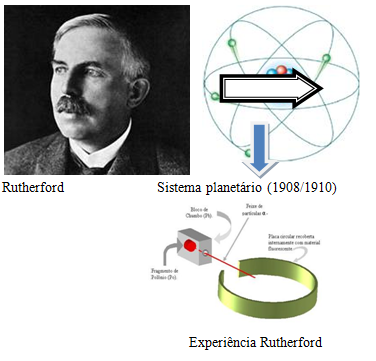
3 – Modelo de Rutherford – No início do Século XX o neozelandês Ernest Rutherford derrubou os conceitos anteriores ao demonstrar através de um experimento de que o átomo não era ‘maciço’.
Rutherford bombardeou lâminas finíssimas de ouro com partículas alfa, e verificou que algumas passavam ‘direto’ e que outras eram desviadas. 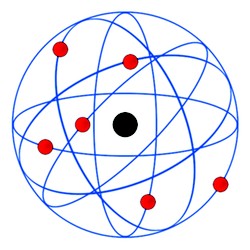 Assim, Rutherford deduziu que os átomos teriam um ‘núcleo’ mais consistente e de carga positiva, e que em torno dele orbitavam os elétrons em movimento circular, e de carga negativa (veja a imagem acima).
Assim, Rutherford deduziu que os átomos teriam um ‘núcleo’ mais consistente e de carga positiva, e que em torno dele orbitavam os elétrons em movimento circular, e de carga negativa (veja a imagem acima).
Veja o Modelo Atômico de Rutherford
.
Postulados de Niels Bohr
A– As diferentes orbitas circulares em torno do Núcleo consistiam-se em ‘camadas eletrônicas’, sendo cada uma delas com o seu próprio nível de energia. Ou seja, uma órbita tem diferente nível energia em relação às demais.
B- Quando os elétrons se movimentam numa mesma camada eletrônica eles não absorvem nem emitem energia espontaneamente.
C– Ao receber energia, o elétron pode saltar para outra órbita, mais energética. Dessa forma, o átomo fica instável, pois o elétron tende a voltar à sua orbita original.
Quando o átomo volta à sua órbita original, ele devolve a energia que foi recebida em forma de luz ou calor. 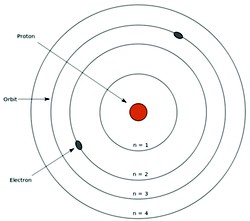 Veja na ilustração acima (fonte e imagem: Globo Educação).
Veja na ilustração acima (fonte e imagem: Globo Educação).
Veja o Modelo Atômico de Niels Bohr
Infográfico sobre a História dos Modelos Atômicos
Que tal dar uma recapitulada de um modo rápido e fácil? Siga com a gente para ver a evolução da Estrutura do Átomo.
Átomo: Uma partícula indivisível.
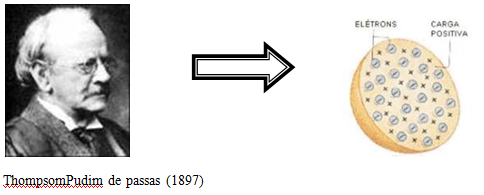
O ‘Pudim de Passas’de Thompson. O átomo enquanto uma Esfera de carga elétrica positiva, não maciça;
O Sistema Planetário para o Modelo do Átomo, com Arthur Rutherford:
Niels Bohr e os níveis de energia: Um Núcleo carregado positivamente e uma nuvem eletrônica carregada negativamente. Essa nuvem eletrônica é composta por elétrons que giram em órbitas elípticas ao redor do núcleo (assim como os planetas ao redor do sol). Os elétrons só se movem ao redor do núcleo quando estão alocados em certos níveis de energia.
Os elétrons só se movem ao redor do núcleo quando estão alocados em certos níveis de energia.
Dessa forma, um elétron só poderia mudar de nível de energia se ganhasse ou perdesse energia.
Exercícios sobre os Modelos Atômicos
Você consegue resolver estes exercícios abaixo? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!
As afirmativas a seguir descrevem estudos sobre modelos atômicos, realizados por Niels Bohr, John Dalton e Ernest Rutherford.
- Partículas alfa foram desviadas de seu trajeto, devido à repulsão que o núcleo denso e a carga positiva do metal exerceram.
- Átomos (esferas indivisíveis e permanentes) de um elemento são idênticos em todas as suas propriedades. Átomos de elementos diferentes têm propriedades diferentes.
III. Os elétrons movem-se em órbitas, em torno do núcleo, sem perder ou ganhar energia.
Assinale a alternativa que indica a sequência correta do relacionamento desses estudos com seus autores.
- a) Rutherford, Dalton, Bohr
- b) Rutherford, Bohr, Dalton
- c) Dalton, Rutherford, Bohr
- d) Dalton, Bohr, Rutherford
Resposta: A

“A disciplina é a parte mais importante do sucesso”
Truman Capote