Hora de rever as classificações, características e a nomenclatura de Ácidos e Bases para a Química do Enem. Aprenda a identificar Ácidos fortes ou fracos, e as Bases fortes ou fracas:
Ácido ou Base? Você precisa calcular o pH ou o pOH? E agora, quais são as principais características e propriedades dos Ácidos e das Bases? Calma que tem solução. Veja aqui uma revisão de Química Enem sobre Funções Inorgânicas: Ácidos e Bases. Não fique de bobeira! Aproveite esta aula e no final responda ao Simulado também!
Você já estudou que as substâncias químicas podem ser agrupadas entre orgânicas e inorgânicas. As inorgânicas são aquelas substâncias que não contém carbono em sua composição.  Mas, não se engane! Lembre-se de que também são consideradas inorgânicas algumas substâncias que contêm carbono, como o dióxido de carbono, monóxido de carbono, grafite, diamante, ácido carbônico, ácido cianídrico, e os sais carbonatos e cianetos.
Mas, não se engane! Lembre-se de que também são consideradas inorgânicas algumas substâncias que contêm carbono, como o dióxido de carbono, monóxido de carbono, grafite, diamante, ácido carbônico, ácido cianídrico, e os sais carbonatos e cianetos.![]() Você lembra qual são as definições de ácidos e bases? Então fique atento! Cai na Fuvest, no Enem e na maioria dos vestibulares.
Você lembra qual são as definições de ácidos e bases? Então fique atento! Cai na Fuvest, no Enem e na maioria dos vestibulares.
As substâncias orgânicas apresentam átomos de carbono os quais, geralmente formam estruturas de átomos de carbono ligados entre si. As substâncias inorgânicas, direta ou indiretamente são de origem mineral. Algumas delas contam também com átomos de carbono, como o dióxido de carbono e o carbonato de cálcio. As quatro principais funções orgânicas são: ácidos, bases, sais e óxidos.
Definições de Ácidos e Bases:
1 – Arrhenius:
- Ácidos são Substâncias que em solução aquosa liberam íons positivos de hidrogênio (H+).
- Bases são Substâncias que em solução aquosa, liberam hidroxilas, íons negativos OH–.
2 – Bronsted-Lowry:
- Ácido é uma substância capaz de ceder um próton a uma reação
- Base é uma substância capaz de receber um próton.
3 – Lewis
- Ácidos são substâncias que em numa ligação química, podem receber pares eletrônicos
- Bases são substâncias que cedem pares eletrônicos
O que é um Ácido?
Confira com o professor Felipe Sobis as características principais dos Ácidos. Ele é do time de professores-show do canal do Curso Enem Gratuito.
Muito bom o resumo do professor Sobis!
como identificar ácido e base?
É possível medir a concentração de hidrogênio iônico em uma solução a partir de uma escala logarítmica inversa, que recebeu o nome de potencial hidrogeniônico, ou simplesmente, escala de pH.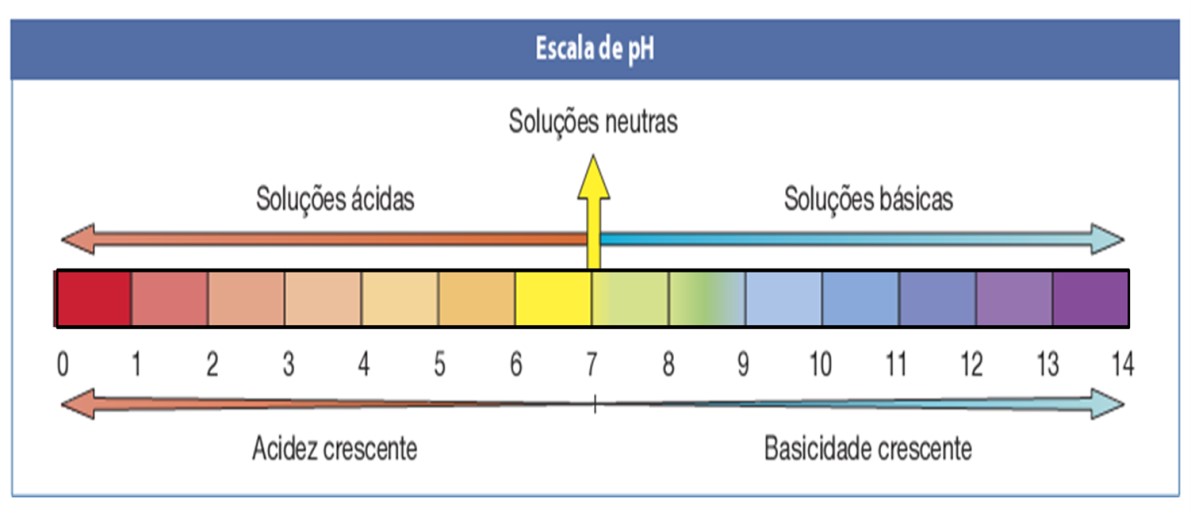 Esta escala vai de zero a 14, sendo o pH 7 considerado neutro. Os valores menores que sete classificam a solução medida como ácida e os maiores que sete, como alcalinos (bases).
Esta escala vai de zero a 14, sendo o pH 7 considerado neutro. Os valores menores que sete classificam a solução medida como ácida e os maiores que sete, como alcalinos (bases).
O que são as Bases?
Agora acompanhe as definições e características das Bases com o professor Felipe Sobis.
Na aula de hoje o professor Sobis fala sobre as bases, substâncias que, segundo Arrhenius, liberam hidroxilas (íons negativos OH–) em solução aquosa. Um exemplo de base é o hidróxido de sódio, comercializado como soda cáustica. É utilizado, por exemplo, em uma das etapas do processo de fabricação do papel, tecidos e produtos de uso doméstico.
A Nomenclatura dos ácidos
Os ácidos podem ser divididos em dois grupos: que contém oxigênio (oxigenados) e os que não contêm (não oxigenados).
Ácidos não oxigenados ou hidrácidos
Exemplos:
- HF – ácido fluorídrico HCl – ácido clorídrico
- HBr – ácido bromídrico HI – ácido iodídrico
- H2Se – ácido selenídrico H2Te – ácido telenídrico
Entenda melhor a nomenclatura de ácidos com a aula do prof. Sobis:
Ácidos oxigenados ou oxiácidos
Quando forma apenas um oxiácido, segue a regra geral:
Ácido + nome do ânion + ico
Se formar mais de um oxiácido com Nox (número de oxidação) diferentes acrescenta-se os prefixos per ou hipo e os sufixos iço ou oso.
Exemplos:
HClO4 (Nox do cloro = +7; 4 átomos de oxigênio): ácido perclórico
HClO3 (Nox do cloro = +5; 3 átomos de oxigênio): ácido clórico – ácido padrão
HClO2 (Nox do cloro = +3; 2 átomos de oxigênio): ácido cloroso
HClO (Nox do cloro = +1; 1 átomo de oxigênio): ácido hipocloroso
Simulado Enem Gratuito – Ácidos e Bases
Agora é a hora de cair na real e testar pra valer o que você aprendeu nesta aula. Resolva as 10 questões do Simulado Enem Gratuit0 e compare seus resultados com os colegas. É gratuito. Vem pro Simulado Enem:
A Nomenclatura das bases:

- Exemplos:
- NaOH – Hidróxido de sódio
- Ferro → Fe2+ e Fe3+
Fe2+ Fe(OH)2 = Hidróxido de ferro (II) ou hidróxido ferroso.
Fe3+: Fe(OH)3 = Hidróxido de ferro (III) ou hidróxido férrico.
Para finalizar sua aula, veja nosso vídeo sobre a nomenclatura das bases





