Você lembra tudo sobre os átomos? Lembra-se de como os cientistas chegaram ao modelo de átomo aceito atualmente? É melhor se ligar, pois cai direto nos vestibulares, no Enem e no Encceja. Revise aqui no blog do Enem com aulas Khan Academy e dicas da professora Munique Dias.
Olá, que tal rever sobre o Átomo de Dalton, de Thomson, de Rutherford, e de Niels Bohr? – É conteúdo muito cobrado nas provas do Enem e dos vestibulares.
O átomo ainda é um assunto que confunde muitos alunos na hora das provas de Química. Mas, não se preocupe! Com as vídeo-aulas da Khan Academy e as explicações da professora Munique Dias você chega mandando bem nas questões de Química do Enem. 
A origem do termo ‘Átomo’
O termo átomo tem origem no grego ἄτομος (atomos, “indivisível”), indicando que seria a menor partícula capaz de identificar um elemento químico, e de participar de uma reação química. ![]() O estudo do átomo se iniciou na Grécia antiga com o filósofo Leucipo de Mileto de Dera e seu discípulo Demócrito (460 a 360 a.C.). Há 2.400 anos eles apontaram que o átomo era o menor componente de toda a matéria existente. Sendo, então, impossível dividi-lo em partes menores.
O estudo do átomo se iniciou na Grécia antiga com o filósofo Leucipo de Mileto de Dera e seu discípulo Demócrito (460 a 360 a.C.). Há 2.400 anos eles apontaram que o átomo era o menor componente de toda a matéria existente. Sendo, então, impossível dividi-lo em partes menores.
Porém, ao desenrolar da história da ciência a partir do final da Idade Média e início da Era Moderna diversos cientistas e estudiosos tentaram definir o átomo quanto a sua forma, dando origem a diversas teorias sobre sua constituição física. Surgiram, então, os seguintes Modelos Atômicos:
- – Em 1803, o modelo de John Dalton;
- – Em 1903 o modelo de John Thomson;
- – Em 1911, o modelo de Ernest Rutherford; e,
- – Eem 1913, o modelo atômico de Niels Bohr, denominado Bohr-Rutherford. Veja a História destes Modelos Atômicos.
- – Viu como não é nada complicada esta história?
Aproveite para entender mais um pouco sobre os átomos:
Estrutura de um átomo: Os átomos são compostos de, pelo menos, um próton, um elétron e um nêutron. Veja na imagem, considerando que prótons e nêutrons formam o núcleo do átomo.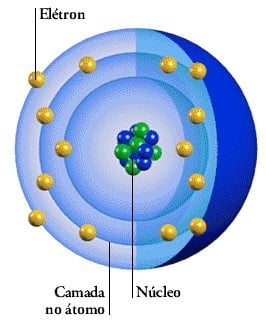 Os prótons e os nêutrons formam o núcleo do átomo, enquanto os elétrons estão distribuídos no espaço em torno do núcleo.
Os prótons e os nêutrons formam o núcleo do átomo, enquanto os elétrons estão distribuídos no espaço em torno do núcleo.
Veja na tabela abaixo algumas características das partículas que compõem o átomo.
|
Partícula |
Símbolo |
Carga |
Massa, Kg |
|
Elétron |
e- |
-1 |
9,109×10-31 |
|
Próton |
p |
+1 |
1,673×10-27 |
|
Nêutron |
n |
0 |
1,675×10-27 |
O número de prótons de um átomo é chamado de número atômico e é representado pela letra Z. O número de massa de um átomo corresponde à soma do número de prótons (Z) com o número de neutros (n), e é representada pela letra A. Assim temos: A=Z+n .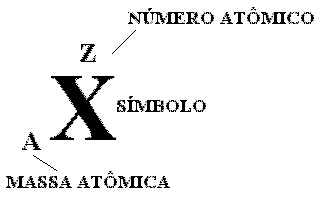
Vamos deixar mais claro? Então veja o exemplo:
Se o átomo de potássio (K) apresenta número de massa 39, qual é o seu número de nêutrons, sabendo que o seu número atômico é igual a 19?
- Dados:
- A=39
- Z = 19
- Então: A=Z+n → 39 = 19 + n →n=39-19 → n=20
- Portanto o número de neutros é igual a 20.
- Não tem segredo. Dá sim para aprender e mandar bem.
A Classificação dos Átomos:
Os átomos podem possuir o mesmo número de massa, de elétrons, de prótons e de nêutrons veja a seguir, como cada uma dessas situações é chamada:
- Isoeletrônicos: São os átomos que possuem a mesma quantidade de elétrons;
- Isóbaros: São os átomos que possuem o mesmo número de massa;
- Isótonos: São os átomos que possuem o mesmo número de neutros;
- Isótopos: São os átomos que possuem o mesmo número de prótons, mas, diferem na quantidade de nêutrons.
Dica 1 – Veja o que mais cai em Química no Enem, e as principais dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Aula Gratuita sobre a Estrutura do Átomo
Quer saber mais sobre os Modelos Atômicos? Assista o vídeo produzido pela PUC Rio em parceria com o Ministério da Educação, o Ministério da Ciência e Tecnologia e o Fundo Nacional de Desenvolvimento da Educação e saiba como os cientistas chegaram ao modelo de átomo aceito atualmente.
Vamos revisar e saber agora como o Átomo ele é formado:
Assista agora ao vídeo da Khan Academy em que o professor Salman Khan ministra uma aula sobre Introdução ao átomo e saia na frente nas questões do Enem e dos vestibulares.
Quer sair na frente nas provas do Enem e dos vestibulares? Saiba mais sobre elementos e átomos assistindo agora a outro vídeo da Khan Academy com o professor Salman Khan.
Dica 2 – Faça revisão Enem com Apostilas Gratuitas. O Blog do Enem selecionou para você, para todas as matérias: https://blogdoenem.com.br/apostilas-gratis/
Gostou dos vídeos? Que tal um desafio?
Encontre os valores que completam a tabela, e responda quais partículas são isótopos.
|
Partícula |
Z |
Partículas por átomo |
A |
||
|
Prótons |
Elétrons |
Nêutrons |
|||
|
A |
# |
83 |
83 |
126 |
# |
|
D |
# |
55 |
54 |
# |
133 |
|
E |
16 |
# |
18 |
16 |
# |
|
G |
# |
56 |
54 |
# |
137 |
|
J |
55 |
# |
55 |
82 |
# |
Resposta:
|
Partícula |
Z |
Partículas por átomo |
A |
||
|
Prótons |
Elétrons |
Nêutrons |
|||
|
A |
83 |
83 |
83 |
126 |
209 |
|
D |
55 |
55 |
54 |
78 |
133 |
|
E |
16 |
16 |
18 |
16 |
32 |
|
G |
56 |
56 |
54 |
81 |
137 |
|
J |
55 |
55 |
55 |
82 |
137 |
São isótopos: D e J, pois possuem o mesmo número de prótons.
Dica 3 – Veja os vídeos da Khan Academy já traduzidos para o Português pela equipe da Fundação Lemann no http://www.fundacaolemann.org.br/khanportugues/#videos
Dica 4 – Veja as notas de corte dos cursos mais disputados nas melhores universidades públicas que participam do Sisu: https://blogdoenem.com.br/notas-corte-universidades/