As relações estequiométricas nas transformações químicas são uma parte da química que causa bastante dificuldade nas provas de vestibulares e do Enem. Envolvem cálculo e conhecimento químico em conjunto. Quem acerta, sai na frente. Explicações e dicas da professora Munique Dias. Veja.
Os cálculos estequiométricos correspondem aos cálculos de massa, de quantidade, de matéria e, em alguns casos, de volume das substâncias envolvidas em uma reação química, que são feitos com base na proporção entre os coeficientes estequiométricos da reação (proporção estequiométrica). Confira!
A primeira pergunta na sua cabeça quando encontra uma questão de balanceamento de reações químicas é esta: Mas o que eu preciso saber para poder resolver questões sobre cálculo estequiométrico?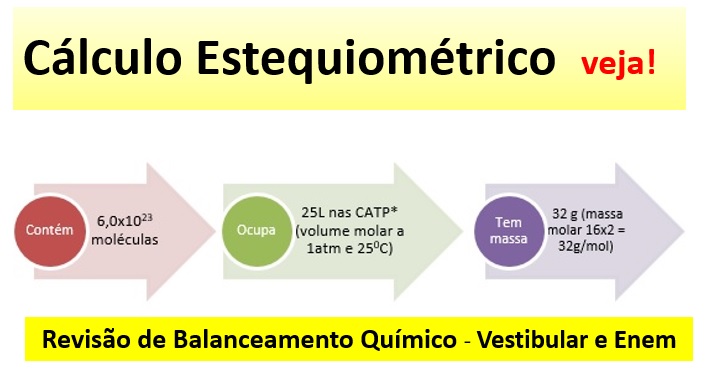 Para você fazer o cálculo estequiométrico de uma reação é necessário conhecer a proporção entre os coeficientes estequiométricos de reação, e isso é possível através do balanceamento das equações químicas.
Para você fazer o cálculo estequiométrico de uma reação é necessário conhecer a proporção entre os coeficientes estequiométricos de reação, e isso é possível através do balanceamento das equações químicas.
BALANCEAMENTO QUÍMICO DAS EQUAÇÕES QUÍMICAS – Vamos a um exemplo bem explicado para você nunca mais errar uma questão de balanceamento químico!
Exercício para você entender Cálculo Estequiométrico. Suponha a seguinte reação:
Ca (OH)2(aq) + Al2(SO4)(aq) →Al(OH)3(s) + CaSO4(s)
O processo de balanceamento pode ser feito de muitas maneiras, sendo o método das tentativas o mais utilizado. Esse método consiste em:
- Iniciar o balanceamento pela espécie que aparece apenas uma vez em cada um dos lados da equação;
- Dar preferência ao elemento que possui maior índice;
Acompanhe a resolução – Veja:
No caso da reação dada existem duas espécies que aparecem apenas uma vez em cada lado da equação, o Alumínio (Al) e o Cálcio (Ca), portanto, vamos dar preferência ao elemento que possui maior índice que é o alumínio.
Ca(OH)2(aq) + Al2(SO4)(aq) → 2Al(OH)3(s) + CaSO4(s)
- Primeiramente começamos igualando a quantidade de alumínio do lado direito com a mesma quantidade do lado esquerdo. Portanto, devemos colocar o número 2, no alumínio do lado direito, já que temos dois átomos de alumínio do lado esquerdo da equação;
- Em seguida contamos o número de cálcio e igualamos nos dois lados da equação, inicialmente colocamos o número 1, pois a principio conseguimos igualar o número de cálcio dos dois lados;
1Ca(OH)2(aq) + Al2(SO4)(aq) → 2Al(OH)3(s) + CaSO4(s)
Agora contamos o número dos hidrogênios, que são 2 hidrogênios do lado direito e 6 hidrogênios do lado esquerdo da equação, então é preciso igualar os hidrogênio do lado esquerdo colocando o número 3 na frente da espécie : Ca(OH)2(aq) para que possamos ter o mesmo número de hidrogênios do outro lado da equação. Assim:
3Ca(OH)2(aq) + Al2(SO4)(aq) → 2Al(OH)3(s) + CaSO4(s)
Ops! Agora o número de átomos de cálcio não é o mesmo nos dois lados da equação. Então é preciso balancear o átomo de cálcio, colocando o número 2 na frente da espécie: CaSO4(s)
2Ca(OH)2(aq) + Al2(SO4)(aq) → 2Al(OH)3(s) + 3CaSO4(s)
OBS: Por isso o método é chamado de tentativa, pois se deve ir ajustando os coeficientes estequiométricos até conseguir o balanceamento total da equação.
- Por último é só verificar o número de oxigênios dos dois lados da equação, se o número estiver correto, o balanceamento da equação está pronto! Que é o caso desse exemplo dado.
Então a equação final balanceada é:
2Ca(OH)2(aq) + Al2(SO4)(aq) → 2Al(OH)3(s) + 3CaSO4(s)
Veja uma aula gratuita de Cálculo Estequiométrico com o professor Sobis
Dica 1 – Já que você precisa relembrar mais sobre o balanceamento químico, o blog do Enem preparou um super-resumo com dicas da professora Munique Dias e videoaulas da Khan Academy para você! Acesse esta aula gratuita e nunca mais esqueça: https://blogdoenem.com.br/quimica-enem-khan-academy/ .
Agora que já sabemos como balancear uma equação, vamos revisar como fazer o cálculo estequiométrico?
CÁLCULO ESTEQUIOMÉTRICO
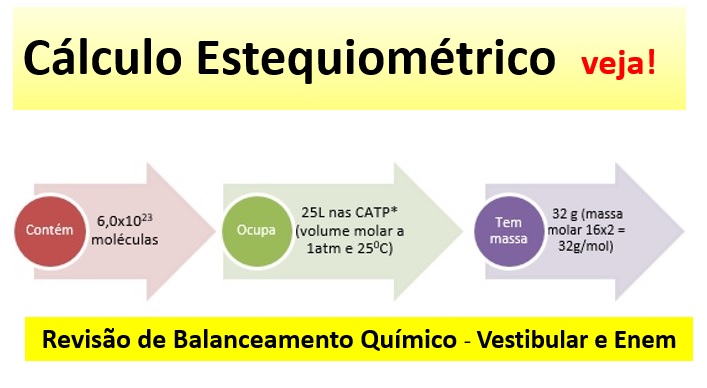
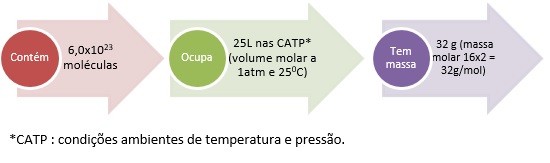
A quantidade de uma substância, em mol, também pode ser expressa em outras grandezas e, portanto, em outras unidades como:
1 mol = 6,0×1023 moléculas = No estado gasoso 25L (volume molar, a 1 atm a 25oC).
Não esqueça! Sempre serão esses valores para mol e volume, porém a massa em gramas dependerá da fórmula de cada substância. Por exemplo:
1 mol de O2:
Dicas para você ver muito mais sobre cálculos estequiométricos?
Dica 2 – O blog do Enem não te deixa na mão! Acesse uma aula completa com vídeos Khan Academy, vídeo dos professores do Kuadro, aula da professora Munique Dias, e aprenda de vez como fazer cálculos estequiométricos: https://blogdoenem.com.br/quimica-enem-revisao/ Veja esta aula, faça os exercícios e vamos lá. É para gabaritar a prova de química da FUVEST, de vestibulares ou do Enem!!
Dica 3 – Prepare-se para o vestibular resolvendo questões da Fuvest, Unicamp, Unesp e Enem. Acesse o site http://guiadoestudante.abril.com.br/estudar/jogos-multimidia/revisao-para-vestibular-647127.shtml.Nele você pode montar a sua própria prova,colocando as matérias que mais tem dificuldade e testando o tempo que demora para resolver cada questão.
TIPOS DE FÓRMULAS para Cálculo Estequiométrico
Nós do blog do Enem, separamos para você uma serie de videoaulas para você revisar alguns conteúdos que fazem parte dos cálculos estequiométricos que são:
Fórmula porcentual ou composição centesimal. Veja aqui nesta videoaula com o pessoal do Kuadro:
Quer ver outras aulas da Khan Academy? Veja aqui os vídeos da Khan Academy já traduzidos para o Português pela equipe da Fundação Lemann http://www.fundacaolemann.org.br/khanportugues/#videos
É isso ai ? Gostou? Agora é só mandar ver nas provas do Enem, dos vestibulares, e da FUVEST!
“Um passo à frente e você não está mais no mesmo lugar.” (Um passeio no mundo livre – Chico Science & Nação Zumbi)