Você conhece aquele galinho do tempo que fica azul ou rosa dependendo da umidade do ar? Dia chuvoso rosa, dia ensolarado (não úmido) azul? Então... Graças ao equilíbrio químico esse fenômeno é possível acontecer! Você lembra o que é? Que tal relembrar tudo sobre o equilíbrio químico das reações? Como? Com aulas do Khan e dicas da professora Munique Dias
Olá, o estudo do equilíbrio das reações químicas é muito importante, pois além de cair muito nas questões do Enem e dos vestibulares, ele é responsável por várias “situações” do nosso cotidiano. Porém, esse é um assunto que confunde muito os alunos na hora das provas. Mas com o resumo que o blog do Enem preparou para você, com videoaulas da Khan Academy e as explicações da professora Munique Dias, as questões dessas provas vão ser moleza! Fique com a gente!
Você é capaz de recuperar uma folha de papel após ela ser queimada?
As reações químicas podem ocorrer de várias maneiras,em alguns casos elas ocorrem de forma completa, ou seja, os reagentes são consumidos durante o processo. Por exemplo, quando queimamos uma folha de papel essa passa a não existir mais, de forma que é impossível recuperar sua forma original. Esse tipo de reação se classifica como irreversível. Em outro caso, existem reações reversíveis onde os produtos podem se converter a sua forma original. Isso pode ocorrer em processos químicos e físicos e são identificados pela seta dupla:
Dica 1 – O que mais cai em Química nos Vestibulares e no Enem? Veja aqui as melhores dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Você deve estar pensando agora em um exemplo de reação reversível não é?
Se você colocar água líquida em um recipiente fechado vai ter uma reação reversível através da equação:
Tanto a vaporização quanto a condensação ocorrem sob a mesma velocidade, e as quantidades relativas de líquido e vapor permanecem constantes no decorrer do tempo. Quando a velocidade de vaporização se iguala à de condensação, o sistema entra em equilíbrio.
Outro exemplo é o do galinho azul, muito utilizado para “prever” o tempo. Ele é formado de um sal de cobalto hidratado que em dias úmidos fica rosa e sem água (dias secos) fica azul.

CoCl2 + 6 H2O ↔ CoCl2.6H2O
sal azul + água ↔ sal rosa
Quer mandar bem nas provas do Enem e dos vestibulares? Assista agora uma super videoaula da Khan Academy sobre equilíbrio químico, ministrada pelo professor Salman Khan. Não deixe de conferir!
http://www.fundacaolemann.org.br/khanportugues//ciencias/quimica/reacoes_em_equilibrio
Dica 2 – Já escolheu a sua profissão? Pense bem antes de entrar em um curso qualquer. Veja aqui a lista das profissões com os 10 piores salários no mercado: https://blogdoenem.com.br/profissao-lista-das-10-piores/
A constante de equilíbrio é representada pela expressão:
Obseve a equação química:
1H2 + 1 I2(g) ↔2HI (g)
O seu equilíbrio pode ser representado pela equação:
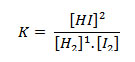
Note que o coeficiente estequiométrico da substância se reverte no expoente da sua concentração.
Dica 3 – Não lembra como encontrar os coeficientes estequiométricos de uma equação química. O blog do Enem te da à dica! Acesse o link: https://blogdoenem.com.br/quimica-enem-khan-academy/ e reveja como fazer, aproveite essa chance!
Tenha em mente!
Mesmo as concentrações das substâncias químicas sendo diferentes para cada experimento, a relação entre elas dada por , apresenta o mesmo valor, desde que mantida a temperatura. Essa expressão é chamada de Lei do Equilíbrio Químico, que também é conhecida como Lei da Ação das Massas.
Veja mais alguns exemplos:
2NO(g) + Cl2 2NOCl(g)
2CO (g) + O2(g) 2CO2(g)
Quer saber mais sobre equilíbrio químico? Assista a videoaula do portal Química Total, com o professor Paulo Valim, e reforce esse conteúdo. Não desista agora!
Agora que já vimos tudo sobre o equilíbrio químico que tal resolver um exercício? È hora de tirar as dúvidas! Vai perder essa chance?
O valor da constante de equilíbrio em função das concentrações das espécies no equilíbrio, em quantidade de matéria, é um dado importante para se avaliar a extensão (rendimento) da reação quando as concentrações não se alteram mais. Considere a tabela com as quantidades de reagentes e produtos no início e no equilíbrio, na temperatura de 100oC, para a seguinte reação:
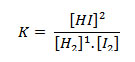
Qual o valor da constante de equilíbrio ?
Resolução:
Como já vimos, a constante de equilíbrio pode ser calculada pela equação:
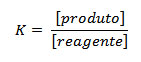
As concentrações utilizadas na equação,deverão ser as concentrações após o alcance do equilíbrio, então:
![]()
Dica 4 – Quer ver outras aulas da Khan Academy? Veja aqui os vídeos da Khan Academy já traduzidos para o Português pela equipe da Fundação Lemann http://www.fundacaolemann.org.br/khanportugues/#videos
Vamos praticar? Resolva o exercício sobre equilíbrio químico e acerte todas as questões nas provas do Enem e dos vestibulares referentes a esse assunto!
Foi aquecido a 250°C um recipiente de 12 litros contendo certa quantidade de PCl5. Sabe-se que, no equilíbrio, o recipiente contém 0,21 mol de PCl5, 0,32 mol de PCl3 e 0,32 mol de Cl2. A constante de equilíbrio, para a dissociação térmica do PCl5, em mol/litro, é:
a) 0,41 mol/litro
b) 0,49 mol/litro
c) 0,049 mol/litro
d) 0,041 mol/litro
e) 0,082 mol/litro
Resposta: A




