Vamos saber mais sobre as propriedades do líquido mais conhecido do mundo? Isso mesmo a Água! Estude com a gente para o Enem e vestibulares do Brasil.
A água cobre mais de 70% da superfície terrestre e é vital para toda a vida no planeta. É a substância mais abundante da natureza, ocorrendo nos rios, lagos, oceanos, mares e nas calotas polares. Dentre os diversos reservatórios, mais de 99 % correspondem aos oceanos, às geleiras e à umidade dos solos e do ar.
Dica 1 – O que mais cai em Química nos Vestibulares e no Enem? Veja aqui as melhores dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
O total de água doce no nosso planeta, corresponde a 40 x 1015 de litros, ou seja 3% de toda água da Terra, (os 97% restantes são de água salgada), onde 2% fazem parte da calota glacial, esta não disponível na forma líquida. Portanto, verdadeiramente apenas 1% do total de água do planeta é de água doce na forma líquida, incluindo-se as águas dos rios, dos lagos e as subterrâneas. Estima-se que apenas 0,02 % deste total corresponda à disponibilidade efetiva de água doce com a qual pode a humanidade contar, em termos médios e globais, para sustentar-se e atender às necessidades ambientais das outras formas de vida, das quais não pode prescindir. Dos 1% da água doce líquida disponível no planeta, 10% esta localizada em território brasileiro.
Dica 2 – Relembre as principais unidades de medidas mais utilizadas nas questões de química dos vestibulares de todo Brasil e no Enem. Acesse o nosso link e veja tudo sobre as unidades e suas conversões. Aproveite essa oportunidade! https://blogdoenem.com.br/unidades-de-medidas-quimica/
O inicio do problema da poluição se deu com a Revolução industrial, trazendo consigo a urbanização e a industrialização. Com a consolidação do capitalismo, propiciado por este momento histórico, o incentivo à produção e acúmulo de riquezas, aliada à necessidade aparente de se adquirir produtos novos a todo o momento, fez com que a ideia de progresso surgisse ligada à exploração e destruição de recursos naturais.
Relembre um pouco mais das propriedades da água assistindo a videoaula do professor Paulo Jubilut e fique fera no assunto!
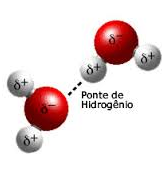
Polaridade da água
A água é uma molécula polar, ou seja, ela tem uma distribuição desigual da densidade dos elétrons. Ela tem uma carga negativa parcial junto ao átomo de oxigênio por causa dos pares de elétrons não compartilhados, e tem cargas positivas parciais junto aos átomos de hidrogênio. A atração eletrostática entre essas cargas resulta na formação de uma ligação chamada de “ponte de hidrogênio”.
Dissolução
Uma das propriedades mais importantes da água líquida é a sua capacidade de dissolver substâncias polares ou iônicas para formar soluções aquosas. Por esse motivo ela é considerada o solvente universal.
Densidade
A água é a única substância que apresenta uma densidade maior quando se encontra no seu estado líquido. O seu valor máximo obtém-se a 4 ºC. Esta particularidade da água pura deve-se às ligações de hidrogênio existentes entre as suas moléculas, que na fase sólida (gelo) formam uma estrutura ordenada, aberta e muito estável. Com baixas temperaturas, a água, na fase líquida, apresenta uma densidade mais alta que na fase sólida.
Capacidade térmica da água (calor específico)
A capacidade térmica da água é bem elevada (1cal/ºC), quando comparada com a maioria das substâncias conhecidas (< 1 cal/ºC). Em outras palavras, a água é capaz de adquirir ou perder muito mais calor que outras substâncias comuns, quando submetida à mesma temperatura.
Dica 3 – Reveja também outro assunto de química que cai bastante nas provas dos vestibulares e do Enem que é Biodiesel. Acesse o nosso blog do Enem e veja um super resumo preparado pela professora Munique Dias. Vai ficar de fora dessa? https://blogdoenem.com.br/quimica-biodiesel-combustivel/
Gostou? Veja agora um resumo sobre as propriedades físicas e químicas da água. Não fique de bobeira! Cai no Enem e também nos vestibulares.
A água em seu estado natural mais comum é um líquido transparente, assumindo a cor azul esverdeada em lugares profundos. Ela é um composto estável que não se decompõe em seus elementos até 13000C. Reage com os metais alcalinos, formando uma base e desprendendo hidrogênio:
Na + H20 →NaOH + H2
Reage com alguns óxidos metálicos para formar hidróxidos, como por exemplo:
CaO + H2O → Ca(OH)2
E com os óxidos não metálicos para formar ácidos
SO2 + H2O → H2SO3
Dica 4 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.