Que tal revisar um pouco de equilíbrio químico? O blog do Enem preparou um super-resumo para você mandar bem nas questões de química do Enem e dos vestibulares de todo Brasil. Estude com a gente!
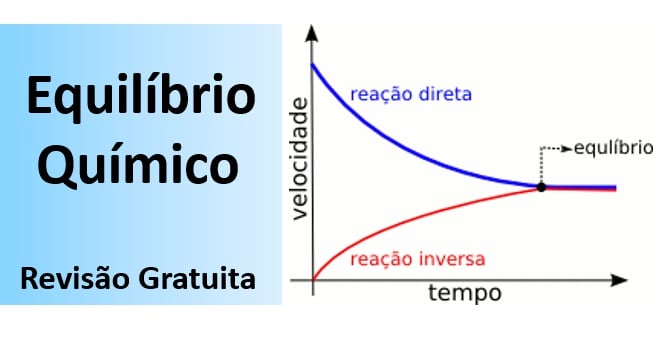
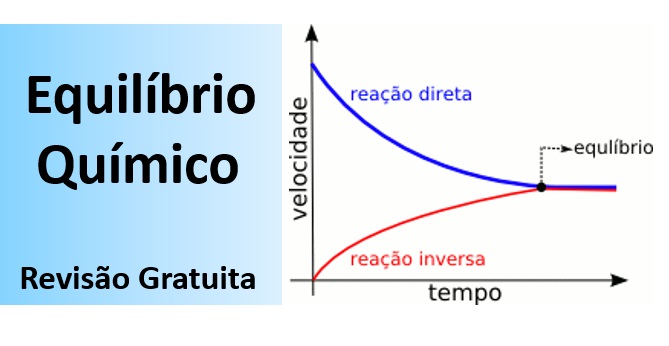
Equilíbrio químico é a situação em que a proporção entre as quantidades de reagentes e produtos em uma reação química se mantém constante ao longo do tempo.
As reações químicas podem ocorrer de várias maneiras, em alguns casos elas ocorrem de forma completa, ou seja, os reagentes são consumidos durante o processo.
Por exemplo, quando queimamos uma folha de papel essa passa a não existir mais, de forma que é impossível recuperar sua forma original. Esse tipo de reação se classifica como irreversível.
Reações Reversíveis
Em outro caso, existem reações reversíveis onde os produtos podem se converter a sua forma original. Isso pode ocorrer em processos químicos e físicos e são identificados pela seta dupla:
![]()
Vamos relembrar como funciona uma reação reversível? Veja o exemplo abaixo, cai no Enem e outros vestibulares!
Se você colocar água líquida em um recipiente fechado vai ter uma reação reversível através da equação:
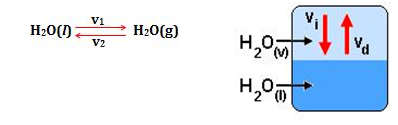
Tanto a vaporização quanto a condensação ocorrem sob a mesma velocidade, e as quantidades relativas de líquido e vapor permanecem constantes no decorrer do tempo. Quando a velocidade de vaporização se iguala à de condensação, o sistema entra em equilíbrio.
Você conhece Princípio de Le Chatelier?
Quando se aplica uma força em um sistema em equilíbrio, ele tende a se reajustar no sentido de diminuir os efeitos dessa força.
Mas que tipo de forças são essas??
Veja um exemplo:
Alterações da acidez e basicidade agem como forças externas em equilíbrios químicos. O sistema precisa então se deslocar para amenizar os efeitos dessa força.
Vamos ver mais alguns exemplos de fatores que podem alterar o equilíbrio de um sistema?
- Concentração
Considere o equilíbrio químico:
![]()
Se adicionarmos mais dióxido carbônico ao equilíbrio, este se desloca para a direita.
Mas porque isso acontece?
O aumento de CO2 (g) acarreta em maior número de choques com C (s) e consequente aumento da velocidade da reação, o que favorece a formação de monóxido de carbono – CO (g). Dizemos então que a concentração do reagente interferiu sobre o equilíbrio.
2. Pressão
Se considerarmos o equilíbrio como sendo gasoso a uma temperatura constante, teremos um deslocamento do equilíbrio no sentido de diminuir o aumento da pressão. Exemplo:
![]()
Repare que a soma da quantidade de mols para os reagentes (3 mol) é maior do que o produto (2 mol).
Um aumento de pressão no sistema favorece a formação de SO3 (g) porque nesse sentido há uma diminuição do número de mol do gás. O equilíbrio tende a deslocar para o lado de menor volume (menor número de mol) e assim a pressão também diminui.
Se diminuirmos a pressão haverá uma expansão de volume dos reagentes e com isso o equilíbrio desloca-se para a esquerda (maior número de mol).
3. Temperatura
Considere que em um equilíbrio ocorre tanto reações endotérmicas como exotérmicas, conforme a equação:
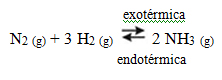
Assim:
– Aumento de temperatura do sistema: o equilíbrio se desloca para a esquerda (Reação endotérmica), para que o calor seja absorvido e não afete o equilíbrio.
– Diminuição de temperatura do sistema: o equilíbrio é deslocado para a direita. (Reação exotérmica) para compensar o calor retirado do equilíbrio.
Dica 1– O que mais cai em Química nos Vestibulares no Enem? Veja aqui as melhores dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Dica 2– Complemente seus estudos acessando o nosso Blog do Enem e conferindo um super-resumo preparado especialmente para você sobre as reações de Neutralização. Não deixe de estudar! https://blogdoenem.com.br/quimica-solucoes-quimicas/
Aula Gratuita
Saiba mais sobre o conceito e as características do equilíbrio químico assistindo a uma super videoaula do Curso Enem Gratuito com o professor Sobis, não deixe de conferir! Aqui ele explica sobre a reversibilidade e equilíbrio químico.
Dica 3 – Fique atento as dicas aqui no nosso Blog. Você já fez sua inscrição para o Enem? Inscrições Abertas Enem 2014: O que precisa? O que cai na prova? Saiba tudo! https://blogdoenem.com.br/inscricoes-enem-2014-saiba-tudo/
Exercício
Agora um desafio para você!
(VUNESP 2009) Considere a reação química que está ocorrendo nas hemácias de uma pessoa.
![]()
A) O pH sanguíneo está aumentando, indicando que essa pessoa está realizando esforço físico intenso
B) A maior parte de gás carbônico presente no sangue é proveniente da quebra da glicose que ocorre no citosol das hemácias.
C) Essa pessoa encontra-se num ambiente com baixa concentração de oxigênio e passa a realizar fermentação láctica que produz gás carbônico baixando o pH sanguíneo.
D) O aumento da acidez sanguínea é prontamente detectado pelo bulbo que aumenta a estimulação dos músculos envolvidos na respiração, aumentando a frequência respiratória.
E) O aumento do teor de gás carbônico no sangue é detectado por receptores químicos localizados nas paredes da veias cavas e artérias pulmonares, que enviam mensagem ao bulbo provocando aumento da frequência respiratória.
Resposta: D
Dica 4 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.