Não lembra mais do conteúdo Soluções Químicas? Não se estresse! O blog do Enem te ajuda a rever esse conteúdo muito cobrado nessas provas, as soluções químicas. Veja as dicas da professora Munique Dias.
O que é mesmo uma solução química?
Bem simples, para você dominar de primeira: Uma solução é uma mistura homogênea entre duas ou mais substâncias. O processo utilizado para obter essa mistura é chamado de dissolução.
Componentes de uma solução
Uma solução é sempre formada pelo soluto e pelo solvente.
Solução = Soluto + Solvente
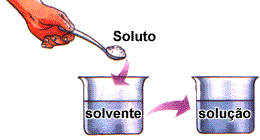 Soluto – substância que será dissolvida.
Soluto – substância que será dissolvida.
Solvente – substância que dissolve.
Complicou? Não tem problema, vamos descomplicar agora com a explicação bem rápida do que são as soluções químicas. Veja com a professora Larissa Campos, do canal do Curso Enem gratuito:
Dica 1 – O que mais cai em Química nos Vestibulares e no Enem? Veja aqui as melhores dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Se liga na água!!!!
A água é chamada de solvente universal. Isso porque ela dissolve muitas substâncias e está presente em muitas soluções.
Não esqueça, cai em vestibulares como o da FUVEST e nas provas do Enem!
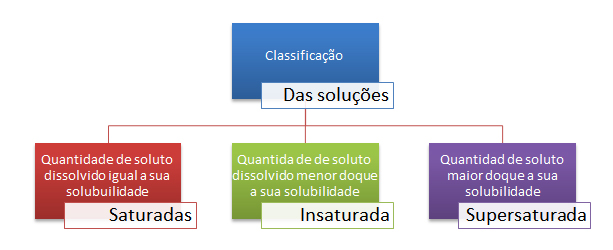
Que tal relembrar sobre a solubilidade das substâncias e se sair muito bem nas provas dos vestibulares e no próximo Enem? O blog do Enem separou um resumo supercompleto, onde você pode acessar totalmente gratuita, videoaulas da Khan Academy e do Kuatro e ainda anotar superdicas da professora Munique Dias. Aproveite!
https://blogdoenem.com.br/quimica-solubilidade-aulas-khan-academy/
Podemos estabelecer diferentes relações entre a quantidade de soluto, de solvente e de solução. Tais relações são denominadas genericamente concentrações.
Usaremos o índice 1 para indicar soluto e o índice 2 para indicar solvente.
Acha difícil decorar fórmulas?
Sabendo disso o blog do Enem preparou para você uma tabela com as relações de concentrações mais utilizadas na química, não deixe de conferir!
|
Nome |
Unidade |
Relação |
Fórmula |
|
Concentração comum ( C ) |
g/L |
Relaciona a massa do soluto em gramas com o volume da solução em litros. |
C = m1/V |
|
Concentração em quantidade de matéria (Cn) |
Mol/L |
Relaciona a quantidade de soluto (mol) com o volume da solução, geralmente em litros |
Cn = n1/V |
|
Título (T) |
Não tem |
Pode relacionar a massa de soluto com a massa da solução ou o volume do soluto com o volume da solução |
T = m1/m e T = V1/V |
|
Densidade da solução (d) |
g/mL ou g/cm3. |
Relaciona a massa e o volume da solução |
d = m/V |
|
As diversas formas de expressar a concentração podem ser relacionadas: C = 1000.d.T |
|||
Saiba mais sobre a concentração das soluções com explicações do conteúdo e exercícios com a aula gratuita do professor Sobis. Não fique pra trás! Faça a diferença na hora das provas dos vestibulares e no próximo Enem.
Dica 2 – Veja dicas de revisão para o vestibular em poucas semanas! No site http://www.examtime.com.br/revisao-para-o-vestibular/
Dica 3 – Prepare-se para o vestibular resolvendo questões da FUVEST, Unicamp, UNESP e Enem. Acesse o site http://guiadoestudante.abril.com.br/estudar/jogos-multimidia/revisao-para-vestibular-647127.shtml, nele você pode montar a sua própria prova,colocando as matérias que mais tem dificuldade, testando o tempo que demora para resolver cada questão.


