Relembre tudo sobre Crioscopia, Osmoscopia e Tipos de Membrana em mais esta aula preparatória para prova de Química Enem
Crioscopia (criometria)
Quando comparamos um solvente puro e uma solução de soluto não volátil, é possível afirmar que o ponto de congelamento da solução sempre será menor que o ponto de congelamento do solvente puro.
Quanto maior a quantidade de partículas dispersas (dissolvidas) em uma solução, menor será o seu ponto de congelamento.
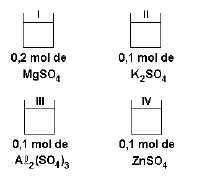
Utilizando o mesmo exemplo da situação anterior, podemos concluir que a ordem crescente de ponto de fusão é:
Soluções III < I < II < IV
Osmoscopia
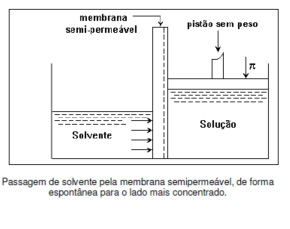
É a passagem de um solvente (líquido) por meio de uma membrana semipermeável, do meio menos concentrado (diluído) para o meio mais concentrado.
Quanto maior a quantidade de partículas dispersas (dissolvidas) em uma solução, maior será a pressão osmótica da mesma.
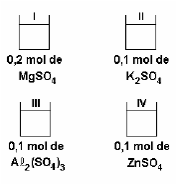
Nas soluções acima, a ordem crescente da pressão osmótica é: IV < II < I < III
É necessário considerar que o solvente, ao passar para o meio mais concentrado, está realizando um processo espontâneo, pois obedece ao sentido natural da osmose.
A passagem do solvente pela membrana ocorre do meio hipotônico para o meio hipertônico a fim de tornar ambos os meios hipotônicos.
Saiba mais com o Curso Enem Gratuito nessa aula gratuito sobre Propriedades Coligativas!
Dica 1 – Saiba tudo sobre Propriedades Coligativas em mais uma aula de Química Enem e fique preparado para gabaritar no Exame Nacional do Ensino Médio – https://blogdoenem.com.br/propriedades-coligativas-quimica-enem/
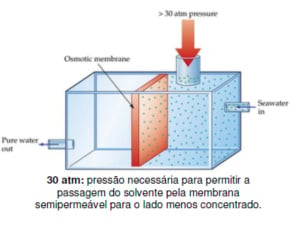
Para impedir a passagem do solvente para o meio mais concentrado, é necessário aplicar uma pressão sobre a solução concentrada, que será chamada de pressão osmótica.
Então concluímos que pressão osmótica é a pressão que deve ser aplicada à solução para não deixar o solvente atravessar a membrana semipermeável.
Tipos de Membrana
Permeáveis: são aquelas que permitem tanto a passagem do solvente quanto do soluto.
Semipermeáveis: são aquelas que permitem apenas a passagem do solvente.
Impermeáveis: são aquelas que não permitem a passagem do solvente nem do soluto.
Saiba mais sobre Crioscopia e Propriedades Coligativas nesta aula do canal Aulalivre.net, disponível no Youtube. Após assistir, revise o que você aprendeu respondendo aos nossos desafios!
[youtube http://www.youtube.com/watch?v=rsUVHKFWW78]
Desafios
Questão 1
Uma das maneiras de se conservar alimentos está representada no esquema abaixo:

Qual o fenômeno que justifica está situação?
a) alotropia
b) osmose
c) crioscopia
d) ebulioscopia
e) tonoscopia
Dica 2 – Revise sobre o Processo de Separação de Misturas com mais esta aula de Química Enem e fique preparado para o Exame Nacional do Ensino Médio – https://blogdoenem.com.br/processos-de-separacao-de-misturas-quimica-enem/
Questão 2
Considerando as propriedades das soluções, assinale a afirmativa INCORRETA:
a) Quando colocamos cloreto de sódio na neve, a neve derrete.
b) Num lugar onde a pressão ambiente é de 720 mmHg, a água aquecida em recipiente aberto ferverá abaixo de 100ºC.
c) Uma solução aquosa de sacarose ferve a uma temperatura mais alta que a água pura a uma mesma altitude em relação ao nível do mar.
d) Sabendo que, nas condições ambientais, a acetona ferve a 56ºC e o benzeno a 80ºC, pode-se concluir que, a 25ºC, a pressão de vapor do benzeno é maior que a pressão de vapor da acetona.
e) A introdução de um soluto não volátil provoca no solvente uma diminuição do seu ponto de congelação.
Dica 3 – Para garantir sua nota no Exame Nacional do Ensino Médio, revise sobre Misturas, Substâncias Puras e suas classificações nesta aula de Química Enem – https://blogdoenem.com.br/misturas-substancias-puras-e-suas-classificacoes-quimica-enem/
Questão 3
Nos invernos rigorosos é costume europeu aspergir cloreto de sódio ou cloreto de cálcio em ruas e estradas cobertas de gelo, bem como adicionar etilenoglicol à água do radiador dos automóveis. Com esses procedimentos, qual alteração se deseja provocar na água?
a) Diminuição da temperatura de ebulição.
b) Aumento da condutibilidade elétrica.
c) Diminuição da densidade.
d) Aumento da pressão de vapor.
e) Diminuição da temperatura de congelamento.
Questão 4
(Ufes) O sistema abaixo é constituído de dois compartimentos separados por uma membrana permeável somente ao solvente (MPS).
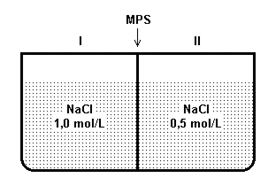
Após o sistema atingir o equilíbrio, pode-se afirmar que:
a) a solução no compartimento II torna-se mais diluída.
b) a solução no compartimento I torna-se mais diluída.
c) a solução no compartimento I torna-se mais concentrada.
d) ocorre diluição nos dois compartimentos.
e) em nenhum dos dois compartimentos ocorre diluição.
Questão 5
“Mesmo em dias sem sol, o banho de mar provoca sede.” Seguem-se as afirmações:
I. A concentração salina da água do mar é mais alta do que as soluções corporais. Em conseqüência, a imersão prolongada no mar provoca saída de água do corpo para a solução mais concentrada – a água do mar. A sede é um recurso natural do organismo para repor a água perdida por esse meio.
II. A concentração salina da água do mar é mais baixa do que as soluções corporais. Em conseqüência, a imersão prolongada no mar provoca a absorção de energia dos raios solares que ficaram retidos durante os dias de sol, provocando assim, a sede.
III. Em dias sem sol, a imersão prolongada no mar provoca o fenômeno conhecido como crioscopia, muito usado na indústria de sorvetes, onde se emprega a salmoura, uma solução saturada de sal marinho.
Destas afirmações:
a) somente I e II são corretas
b) somente I e III são corretas
c) somente I é correta
d) somente III é correta
e) somente II e III são corretas
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!
