Saiba tudo sobre Propriedades Coligativas em mais uma aula de Química Enem. É um conteúdo avançado. Quem acerta já fica em vantagem. Então, faça a sua revisão aqui e fique preparado para gabaritar Química no Exame Nacional do Ensino Médio. Confira abaixo.
Propriedades Coligativas – Você está em dia para responder questões sobre Propriedades Coligativas no Enem ou no Vestibular? Se você parou para pensar um segundo é porque está em dúvida. O melhor a fazer é revisar. Venha com o Blog do Enem. Em dez minutos você recupera o conteúdo que cai em Química no Enem.
As Propriedades Coligativas – São chamadas de propriedades coligativas das soluções aquelas que se relacionam diretamente com o número de partículas de soluto, que se encontram dispersas (dissolvidas) em um determinado solvente.
Pressão de vapor – Fatores que influenciam a pressão de vapor
Na prática, fenômenos como a elevação no ponto de ebulição da água, diminuição do ponto de congelamento da água, diminuição da pressão de vapor dos líquidos, aumento da pressão osmótica (aumento da pressão sanguínea) e outros acontecimentos estão diretamente relacionados não só com a presença, mas com o número de partículas de soluto que está presente em uma determinada quantidade de solvente.
Daremos o nome a esses fenômenos de Tonoscopia, Crioscopia, Ebulioscopia e Osmoscopia. Antes de analisar tais fenômenos, temos que levar em conta o comportamento das soluções iônicas e moleculares.
Aula de introdução: Solutos e solventes
Veja um resumo simples e rápido com a professora Larissa, do Curso Enem Gratuito, que vai ajudar você a compreender o conteúdo completo desta revisão:
Soluções Moleculares
Observe este processo: 1mol de C6H12O6 → 1mol de C6H12O6
Quando dissolvemos 1mol de glicose, por exemplo, estamos diluindo 6,02.1023 partículas. Após a diluição temos um total de 6,02.1023 partículas, isto é, o mesmo número inicial. Então, quando estamos trabalhando com um soluto molecular, o número de total de partículas presentes na solução é o número de partículas adicionado.
As Soluções Iônicas
Quando a solução é de natureza iônica, devemos considerar outro acontecimento além da diluição, a dissociação. Observe: H2SO4 2H+ + SO4-2
Quando dissolvemos 1mol de ácido sulfúrico, o mesmo sofre dissociação produzindo 2mols de H+ e mol de SO4-2, isto é, 3mols de partículas (íons). Esses íons criam uma certa interação com as moléculas de água, influenciando em algumas propriedades e fenômenos físicos.
- Obs. devemos levar em consideração o grau de ionização da substância.
- Exemplo: Aℓ2(SO4)3 α = 50%
Isso quer dizer que, ao dissolvermos 1mol de sulfato de alumínio Aℓ2(SO4)3 em água, apenas 0,5 mol desse sal sofrerá dissociação, restando 0,5 mol de partículas não dissociadas que devemos considerar.
Aℓ2(SO4)3 → 2Aℓ+3 + 3SO4-2
A Pressão de Vapor
A pressão de vapor é a pressão que os vapores de uma substância exercem a uma determinada temperatura em um equilíbrio entre as fases líquido e vapor.
Considere dois frascos, um deles contendo água e outro álcool. Ambos os frascos contém o mesmo volume de líquido e estão à mesma temperatura. Com o auxílio de um manômetro verifica-se que, após algum tempo, a pressão no interior no frasco contendo álcool é maior, em relação à pressão no interior no frasco contendo água.
Conclui-se que há uma maior formação de vapores no frasco contendo álcool, logo este é um líquido mais volátil. Quanto mais volátil uma substância, maior a sua pressão de vapor.
Pressão de Vapor X Temperatura
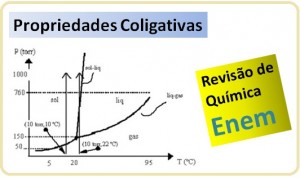
Quando se aquece um líquido, a quantidade de vapor tende a aumentar conforme o tempo (cada substância se comporta de maneira distinta), o que fará com que aumente a pressão de vapor. É o que podemos observar no seguinte gráfico.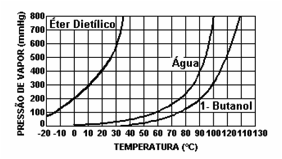 No momento em que um determinado líquido entra em ebulição, ele acabou de igualar sua pressão de vapor com a pressão atmosférica.
No momento em que um determinado líquido entra em ebulição, ele acabou de igualar sua pressão de vapor com a pressão atmosférica.
Considerando que em regiões de maior altitude a pressão atmosférica é menor, o ponto de ebulição do líquido será menor, logo sua pressão de vapor diminuirá.
- Pressão de vapor = Pressão atmosférica = Ponto de ebulição
- Nível do mar = 1 atm = água PE 100º C
- Monte Everest = 0,32 atm = água PE 71º C
Diagrama de Fases
Esse gráfico abaixo deixa claro que a temperatura e a pressão influenciam diretamente no ponto de ebulição de um líquido (água, por exemplo) e que a uma determinada temperatura e pressão específica ocorre o ponto triplo, onde as três fases (sólido, líquido e gasoso) coexistem.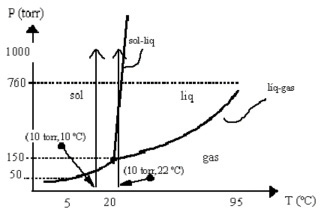
Tonoscopia
- A pressão de vapor de um solvente puro será sempre maior do que a pressão de vapor dele em solução.
- Estuda a diminuição da pressão máxima de vapor de um solvente quando se adiciona a ele um soluto não volátil.
Ebulioscopia
- Em relação ao ponto de ebulição de uma solução, é possível afirmar que ele sempre será maior que o ponto de ebulição do solvente puro.
- Quanto maior a quantidade de partículas dispersa em uma solução, maior será o seu ponto de ebulição.
- Ebulioscopia é o estudo do aumento do ponto de ebulição de um solvente quando se adiciona a ele um soluto não-volátil.

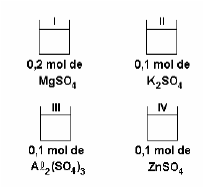
Neste conjunto de soluções podemos concluir que a ordem crescente do ponto de ebulição é: IV < II < I < III
Aula com exercício resolvido
Saiba mais sobre Pressão e Mudança de Fase nesta resolução de Exercício com o professor Marcelo. Após assistir, revise o que você aprendeu respondendo aos nossos desafios!
Dica 1 – Revise sobre o Processo de Separação de Misturas. Veja aqui com mais esta aula de Química Enem e fique preparado para o Exame Nacional do Ensino Médio.
Dica 2 – Para garantir sua nota no Exame Nacional do Ensino Médio, revise aqui Misturas, Substâncias Puras e suas classificações nesta aula de Química Enem.
Dica 3 – O Exame Nacional do Ensino Médio cobra questões avançadas de Química. Quem acerta, sai na frente! Revise aqui Geometria e Polaridade Molecular nesta aula de Química Enem.
Exercícios – Desafios para você resolver e compartilhar a resposta!
Questão 1 – Ao se cozinhar alimentos em panela de pressão, a temperatura atingida pela água é superior a 100ºC, principalmente porque:
a) as substâncias dissolvidas na água aumentam o seu ponto de ebulição
b) o vapor excedente é liberado por uma válvula de segurança
c) a pressão a que o líquido está submetido é maior que 1 atm
d) a água apresenta menor pressão de vapor nessas condições
e) outros líquidos liberados durante o processo elevam a pressão de vapor do sistema.
Questão 2 – Foi observado que o cozimento de meio quilo de batatas em 1 litro de água é mais rápido se adicionarmos 200 gramas de sal à água de cozimento. Considere as seguintes possíveis explicações para o fato:
1 – a adição de sal provoca um aumento da temperatura de ebulição da água;
2 – a adição de sal provoca um aumento da pressão de vapor da água;
3 – o sal adicionado não altera a temperatura de ebulição da água, mas reage com o amido das batatas.
Está(ão) correta(s) a(s) explicação(ões):
a) 1 apenas
b) 2 apenas
c) 3 apenas
d) 1 e 2 apenas
e) 1, 2 e 3.
Questão 3 – A uma dada temperatura, possui a MENOR pressão de vapor a solução aquosa:
a) 0,1 mol/L de sacarose.
b) 0,2 mol/L de sacarose.
c) 0,1 mol/L de ácido clorídrico.
d) 0,2 mol/L de ácido clorídrico.
e) 0,1 mol/L de hidróxido de sódio.
Questão 4 – Aquecendo água destilada numa panela aberta e num local onde a pressão ambiente é 0,92atm, a temperatura de ebulição da água:
a) será inferior a 100°C
b) depende da rapidez do aquecimento
c) será igual a 100°C
d) é alcançada quando a pressão máxima de vapor saturante for 1atm.
e) será superior a 100°C.
Questão 5 – Em um mesmo local, a pressão de vapor de todas as substâncias puras líquidas:
a) tem o mesmo valor à mesma temperatura.
b) tem o mesmo valor nos respectivos pontos de ebulição.
c) tem o mesmo valor nos respectivos pontos de congelação.
d) aumenta com o aumento do volume do líquido presente, à temperatura constante.
e) diminui com o aumento do volume de líquido presente, à temperatura constante.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!