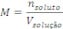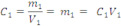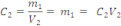Hora de caprichar no resumo sobre Densidade, Massa, Molaridade, ppm, Diluição e outros fatores que estão presentes nos cálculos de Concentração das Soluções Químicas.
Todos os dias lidamos com medidas de concentração de diferentes soluções. Por exemplo, quando observamos o teor alcoólico de uma bebida, estamos observando a concentração de álcool contida naquele volume.
De um modo geral, usamos o termo concentração de uma solução para nos referirmos a qualquer relação estabelecida entre a quantidade de soluto e a quantidade do solvente (ou da solução).
1 – Veja no resumo o que você precisa saber para mandar bem nas questões sobre Concentração das Soluções Químicas. Aprenda o conceito sobre Concentração Comum, ou, simplesmente Concentração:
Concentração é a razão entre a massa do soluto (em gramas) e o volume da solução (em litros). 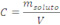
2 – Veja também o conceito de Densidade, que também é fundamental para o domínio básico sobre os temas de Química a respeito das Concentrações: ![]() Densidade é a razão entre a massa e o volume que um corpo ocupa.
Densidade é a razão entre a massa e o volume que um corpo ocupa.
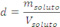
3 – Título em massa. ou, simplesmente título: ![]() Título é a razão entre a massa do soluto e a massa da solução.
Título é a razão entre a massa do soluto e a massa da solução. 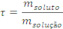
4 – Título percentual: ![]() Título Percentual é a razão entre a massa do soluto e a massa da solução, multiplicado por 100.
Título Percentual é a razão entre a massa do soluto e a massa da solução, multiplicado por 100.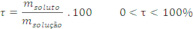
Confira um resumo simples sobre Concentração e Soluções Químicas:
Veja com o professor Sobis uma aula rápida com os fundamentos que você precisa dominar sobre a Concentração Comum nas soluções químicas.
Muito boa esta aula do professor Sobis. Têm mais aulas com ele no canal do Curso Enem Gratuito.
ppm (concentração em partes por milhão)
A Concentração em Partes por Milhão é a razão entre a massa do soluto e a massa ou volume da solução em parte por milhão. Por exemplo:
- 1 ppm = 1 mg de soluto por kg de solução ou 1μg de soluto por g de solução.
- 1ppm = 1 mg de soluto por L de solução ou 1μg de soluto por mL de solução.
Concentração molar ou molaridade (M):  É a razão entre o número de mols de soluto e o volume da solução (em L).
É a razão entre o número de mols de soluto e o volume da solução (em L).
A Diluição das soluções
Diluir uma solução consiste em adicionar mais solvente puro a esta, ou seja, diminuir a proporção de soluto na solução pelo aumento de volume do solvente.
- Para a solução inicial:

- Para a solução final:

- Como a massa ou número de mols de soluto é invariável, temos:

Mistura de soluções de mesmo soluto
Devemos encontrar a massa ou o número de mols total do soluto e após relacionar a diluição.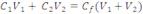
Onde C1V1 representa o número de mols ou a massa do soluto na solução 1, C2V2 representa o número de mols ou a massa do soluto na solução 2, (V1 +V2) é o volume final e Cfé a concentração final do soluto.
Titulação é a Análise volumétrica ou volumetria é o processo de análise química quantitativa, no qual é possível determinar a concentração de um soluto pela medida do volume de uma solução titulada com um reagente de concentração conhecida.
- Titulação ácido-base – Veja no Exemplo:
- Iremos titular 50 mL uma solução aquosa de KOH com uma solução de HBr 0,1000 M. Chamamos o KOH de titulado e o HBr de titulante.
- A reação de um ácido e uma base forma sal e água (neutralização).
Reação balanceada
- HBr + NaOH → NaBr + H2O
- Pelos dados da reação, sabemos que 1 mol de HBr reage com um mol de NaOH, logo
- CHBr VHBr = CNaOH VNaOH
- Chama-se ponto de equivalência o ponto onde o número de mols do titulado é igual ao número de mols do titulante.
Dica 1 – Relembre tudo sobre Dispersões em mais esta aula preparatória para a prova de Química Enem. Estude com a gente para o Exame Nacional do Ensino Médio! – https://blogdoenem.com.br/dispersoes-quimica-enem/
Titulação de precipitação e titulação de oxirredução são outros exemplos de titulação.
Veja nossa aula sobre Diluição em Soluções Químicas:
Gostou deste resumo sobre a Diluição de Soluções Químicas? Parabéns! O professor Sobis é mesmo um craque.
Desafios sobre a Concentração em Soluções Químicas
Questão 1 sobre Concentração e Soluções Químicas
Em uma horta, que contém um solo com deficiência de nitrogênio, foi adicionado o sulfato de amônia, que pode ser produzido a partir da reação
2NH3(g) + H2SO4(aq) → (NH4)2SO4(s)
e é fonte de nitrogênio, como nutriente principal.
Em uma síntese de laboratório, é necessário preparar uma solução de H2SO4 0,1 mol/L.
O volume, em mL, de uma solução 5 mol/L que deve ser pipetado, para se obterem 50 mL da solução 0,1 mol/L;
a) 0,1
b) 0,5
c) 1,0
d) 5,0
e) 50,0
Dica 2 – Relembre tudo sobre as Fontes Energéticas em mais esta aula preparatória para a prova de Química Enem. Estude conosco para o Exame Nacional do Ensino Médio! – https://blogdoenem.com.br/fontes-energeticas-quimica-enem/
Questão 2
(ENEM)
Para se obter 1,5 kg do dióxido de urânio puro, matéria-prima para a produção de combustível nuclear, é necessário extrair-se e tratar-se 1,0 tonelada de minério.
Assim, o rendimento (dado em % em massa) do tratamento do minério até chegar ao dióxido de urânio puro é de:
a) 0,10 %
b) 0,15 %
c) 0,20%
d) 1,5 %
e) 2,0 %
Dica 3 – Revise tudo sobre o Cálculo de DeltaH, Entalpia e Entropia em mais uma aula de Química Enem – https://blogdoenem.com.br/calculo-de-%CE%B4h-quimica-enem/
Questão 3
O oxalato de cálcio, CaC2O4, é encontrado nas folhas de espinafre, nas sementes do tomate, e é um dos constituintes das pedras formadas nos rins (cálculo renal). (C= 12 g/mol; O= 16 g/mol; Ca= 40 g/mol). Uma alíquota de 25 cm3 de uma solução aquosa de oxalato de cálcio contém 0,2625 g desse sal. Qual é a concentração comum de CaC2O4, nessa solução?
a) 0,0105 g/L
b) 0,00656 g/L
c) 10,5 g/L
d) 21 g/dm3
e) 31,5 g/cm3
Questão 4
O limite máximo de concentração de íon Hg2+ admitido para seres humanos é de 6 mg/L de sangue. (Hg= 200 g/mol). O limite máximo, expresso em mols de Hg2+ por litro de sangue, é igual a:
a) 3×10-5
b) 6×10-5
c) 3×10-2
d) 6
e) 200
Questão 5
A solução aquosa de NaOH (soda cáustica) é um produto químico muito utilizado. Uma determinada indústria necessitou usar uma solução com 20% em massa de hidróxido de sódio, que apresenta uma densidade de 1,2 kg/L. (Na= 23 g/mol; O= 16 g/mol; H= 1 g/mol). Qual a molaridade dessa solução?
- a) 12 M
- b) 6 M
- c) 3 M
- d) 2 M
- e) 1 M
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!