Relembre sobre os principais tipos de Pilhas nesta aula de Química Enem sobre Células Secundárias, Células Primárias e Células Combustível. Veja as pilhas de Chumbo, de Níquel-Cádmio, e as baterias de Lítio. Estude conosco!
Revisão de Quimica Enem sobre Pilhas. Confira abaixo como são as principais pilhas usadas e seus funcionamentos.
Pilhas formadas por Células Secundárias: São células galvânicas que podem ser recarregadas antes do uso, são recarregáveis (baterias de carros, computadores, celulares, entre outros).
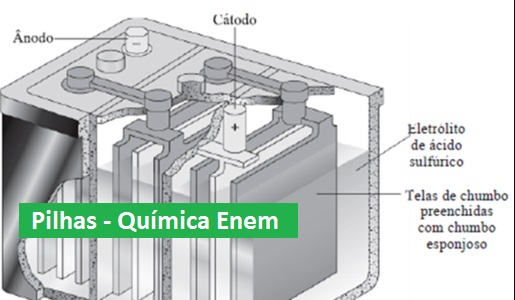
Acumulador ou bateria de automóvel (chumbo/ácido):
É uma associação de pilhas (ou elemento) ligadas em série. Cada pilha gera aproximadamente tensão de 2 Volts. Certos metais traço (impurezas) presentes no sistema diminuem a vida da bateria, pois são oxidados pelo ácido sulfúrico e liberam hidrogênio. 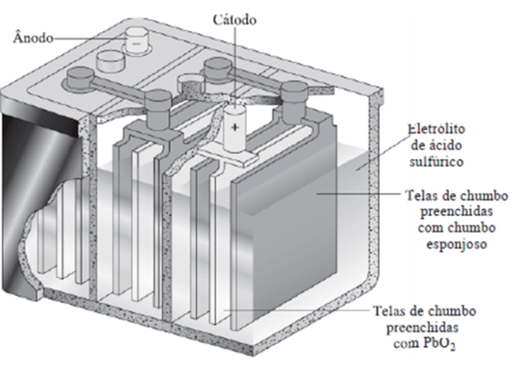 A diferença fundamental entre uma bateria com garantia de 48 meses e uma de 72 meses é a concentração de impurezas nela.
A diferença fundamental entre uma bateria com garantia de 48 meses e uma de 72 meses é a concentração de impurezas nela.
- A reação global quando a célula está descarregada é: Pb(s) + PbO2(s)+ 2HSO4– + 2H+ → 2PbSO4(s) + 2H2O
- No ânodo: polo negativo : {Pb + SO42- → PbSO4 + 2e–
- No cátodo: polo positivo: {PbO2 + SO42- + 4H+ + 2e– → PbSO4 + 2H2O
- Obs.: Durante a recarga, as reações acima se invertem.
A bateria de chumbo/ácido comporta-se como uma célula galvânica (pilha) durante a descarga e como uma célula eletrolítica quando está sendo carregada. Eram usadas, no passado, como fontes de tensão em eletrólise, porém, foram superadas pelas fontes modernas ligadas à rede elétrica.
Eram usadas, no passado, como fontes de tensão em eletrólise, porém, foram superadas pelas fontes modernas ligadas à rede elétrica.
Veja as dicas básicas sobre Pilhas e Baterias:
- Potencial: 2 V, em uma série de seis pilhas = 12 V
- Vantagens – muito barata, alta densidade de potência, vida útil longa, recarga fácil.
- Desvantagens – feita de chumbo (tóxico), pode gerar gás hidrogênio no cátodo quando está sendo recarregada (explosivo) e tem baixa energia específica.
Pilha de Níquel-Cádmio – Nicad (Ni/Cd)
Pilha usada em aparelhos celulares, computadores. Devido à toxicidade do cádmio, está sendo substituída por baterias de lítio.
Potencial – 1,25 V
Reações que ocorrem nesse tipo de pilha:
Cd(s) | Cd(OH)2(s) | KOH(aq) | Ni(OH)3(s) | Ni(OH)2(s) | Ni(S), 1,25V
Ânodo: Cd(s) + 2OH–(aq) → Cd(OH)2(s) + 2e–
Cátodo: 2 Ni(OH)3(s) + 2e– → 2Ni(OH)2(s) + 2 OH–(aq)
Baterias de Lítio
Usadas em celulares, computadores entre outros aparelhos devido ao lítio não ser tóxico.
Potencial – 3,7 V
Pilha sódio-enxofre
É uma das baterias mais surpreendentes. Tem reagentes líquidos (sódio e enxofre) e um eletrólito sólido (uma cerâmica porosa de óxido de alumínio); deve operar a temperaturas próximas a 320ºC, é altamente perigosa em caso de quebra. Tem aplicação em células elétricas (2.000 células de sódio-enxofre) usadas em automóveis elétricos.
Potencial – 2,2 V
Vantagens – energia específica muito alta.
Densidade – caríssima, leva 6h para recarregar, vida curta, o sódio é altamente reativo (pode explodir em contato com a água ou ar atmosférico).
Reações que ocorrem nesse tipo de pilha:
Na(l) | Na+ (solução) || S2-(solução | S(l), 2,2 V
Ânodo: 2 Na(l) → 2 Na+ (solução) + 2e–
Cátodo: S8(l) + 16e– → 8 S2- (solução)
Pilhas formadas por Células Primárias
As células primárias são células galvânicas com os reagentes selados dentro de um recipiente. Elas não podem ser recarregadas, ou seja, devem ser descartadas após descarregadas.
- Pilhas secas
São as pilhas comuns usadas em rádios, lanternas, aparelhos portáteis em geral. Possuiemuma vasilha cilíndrica de zinco como ânodo e, no centro, fica o cátodo, um bastão de carbono.
O interior da vasilha é forrado com papel que serve como barreira porosa. O eletrólito é uma mistura pastosa e úmida de cloreto de amônio, óxido de manganês(IV), carbono finamente pulverizado, e um suporte inerte, usualmente goma.
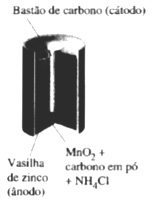
Pilha Seca
Tem potencial de 1,5 V, diminuindo com o uso até 0,8 V.
Vantagens – baixo custo, feita de material não tóxico.
Desvantagem – não pode ser reciclada, pode vazar, curta vida útil, potencial e corrente instáveis.
Reações que ocorrem nesse tipo de pilha.
Zn(s) | ZnCl2(aq), NH4Cl(aq) | MnO(OH)(s) | MnO2 (S) | grafite
Ânodo: Zn(s) → Zn2+ (aq) +2e– seguida por: Zn2+(aq) + 4 NH3(g) → [Zn(NH3)4]2+(aq)
Cátodo: MnO2(s) + H2O(l) e– → MnO(OH)(s) + OH–(aq)
seguida por: NH4+(aq) + OH–(aq) → H2O(l) + NH3(g)
Pilha alcalina
Usa eletrólito alcalino, com o qual o eletrodo de zinco não reage diretamente quando a bateria não está sendo usada.
Potencial = 1,5 V
Vantagens – baixo custo, feita de materiais não tóxicos, vida útil relativamente longa (cerca de 5 anos), corrente e potencial estáveis, pouco risco de vazamento.
Desvantagens – não pode ser reciclada, mais cara que a convencional.
Reações que ocorrem nesse tipo de pilha:
Zn(s) | ZnO(s) | OH-(aq) | Mn(OH)2(s) | MnO2(s) | grafite, 1,5 V
Ânodo: Zn(s) + 2 OH– (aq) → ZnO(s) + H2O(l) + 2e–
Cátodo: MnO2(s) + 2H2O(l) + 2 e– → Mn(OH)2(s) + 2 OH–(aq)
Pilha Zn/Ag
Tem um cátodo de Ag2O.
Potencial – 1,6 V
Vantagens – pode ser feita em tamanhos muito pequenos, aplica um potencial confiável e estável por longo período de tempo, tem toxicidade relativamente baixa.
Desvantagem – não pode ser reciclada, muito cara.
Reações que ocorrem nesse tipo de pilha:
Zn(s) | ZnO(s) | KOH(aq) | Ag2O(s) | Ag(s) | aço, 1,6V
Ânodo: Zn(s) + 2 OH–(aq) → ZnO(s) + H2O(l) + 2 e–
Cátodo: Ag2O(s) + H2O(l) + 2 e– → 2Ag(s) + 2 OH–(aq)
Células a combustível
Nos primeiros anos do programa espacial, manter a vida no espaço era um dilema, pois as espaçonaves precisavam ser leves e terem fontes de energia eficientes (as baterias eram muito pesadas e a combustão desperdiçava muita energia).
A célula combustível, desenvolvida por Francis Bacon, gera eletricidade diretamente de uma reação química, como em uma bateria, mas usa reagentes que são fornecidos continuamente, como em um motor.
A célula combustível de hidrogênio/oxigênio foi produzida para ser usada como combustível espacial e tem por vantagem gerar como único produto a água, que pode ser bebida pela tripulação (a fonte de água no espaço também era um problema).
Saiba mais sobre Pilhas nesta aula do Curso Enem Gratuito, disponível no Youtube. Após assistir, revise o que você aprendeu respondendo aos nossos desafios!
Desafios
Questão 1
(UFRGS)
Um acumulador de chumbo (bateria convencional) é uma célula galvânica que funciona através das semirreações abaixo, cujos potenciais de redução estão especificados:
PbSO4 + H+ + 2e– → Pb + HSO4–
Eº = -0,300 V
PbO2 + HSO4– + 3H+ + 2e– → PbSO4 + 2H2O
Eº = 1,630 V
Com base nesse dados, são feitas as seguintes afirmações:
I- há deposição de PbSO4 no cátodo e no ânodo;
II- no processo, há consumo de ácido sulfúrico;
III- dióxido de chumbo é empregado na constituição do ânodo;
IV- são necessárias, seis células desse tipo ligadas em série para a obtenção de uma tensão nominal aproximada de 12 V.
Quais estão corretas?
a) apenas I e III.
b) apenas II e IV.
c) apenas IV.
d) apenas I, II e IV.
e) I, II, III e IV
Dica 1 – Estude tudo sobre Pilhas: Células Galvânicas em mais esta aula de revisão para a prova de Química Enem. O Exame Nacional do Ensino Médio está chegando! – https://blogdoenem.com.br/pilhas-quimica-enem/
Questão 2
Pilhas e baterias são dispositivos tão comuns em nossa sociedade que, sem percebermos, carregamos várias delas junto ao nosso corpo (aparelhos de MP3, relógios, rádios, celulares, etc.). As semirreações, descritas a seguir, ilustram o que ocorre em uma pilha de óxido de prata.
Zn(s) + OH–(aq) → ZnO(s) + H2O(l) + e–
Ag2O(s) + H2O(l) + e– → Ag(s) + OH–
Pode-se afirmar que esta pilha:
a) É uma pilha ácida.
b) Apresenta o óxido de prata como ânodo.
c) Apresenta o zinco como agente oxidante.
d) Tem como reação de células a seguinte reação: Zn(s) + Ag2O(s) → ZnO(s) + 2 Ag(s).
e) Apresenta fluxo de elétrons na pilha do eletrodo de Ag2O para o Zn.
Dica 2 – Relembre tudo sobre Equilíbrio Iônico em mais esta aula preparatória para a prova de Química Enem. Estude com a gente para o Exame Nacional do Ensino Médio! – https://blogdoenem.com.br/equilibrio-ionico-quimica-enem/
Questão 3
A pilha de sódio-enxofre, usada em automóveis movidos a energia elétrica, é uma inovação. Quanto a ela é correto afirmar:
a) Funciona a temperatura ambiente.
b) Tem baixo custo de fabricação.
c) Altamente estável e segura.
d) Facilmente recarregada.
e) Possui vida útil curta.
Dica 3 – Tire todas as suas dúvidas e fique preparado para a prova de Química Enem com mais esta aula sobre o Equilíbrio Químico. – https://blogdoenem.com.br/equilibrio-quimico-quimica-enem/
Questão 4
O crescimento da produção de energia elétrica ao longo do tempo tem influenciado decisivamente o progresso da humanidade, mas também tem criado uma séria preocupação: o prejuízo ao meio ambiente.
Nos próximos anos, uma nova tecnologia de geração de energia elétrica deverá ganhar espaço, as células a combustível hidrogênio/oxigênio.
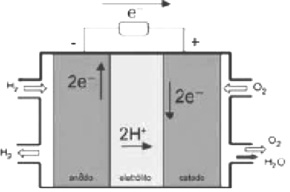
Com base no texto e na figura, a produção de energia elétrica por meio da célula a combustível hidrogênio/oxigênio diferencia-se dos processos convencionais porque:
a) transforma energia química em energia elétrica, sem causar danos ao meio ambiente, porque o principal subproduto formado é a água.
b) converte a energia química contida nas moléculas dos componentes em energia térmica, sem que ocorra a produção de gases poluentes nocivos ao meio ambiente.
c) transforma a energia química em energia elétrica, porém emite gases poluentes da mesma forma que a produção de energia a partir de combustíveis fósseis.
d) converte a energia elétrica proveniente dos combustíveis fósseis em energia química, retendo os gases poluentes produzidos no processo sem alterar a qualidade do meio ambiente.
e) converte a energia potencial acumulada nas moléculas de água contidas no sistema em energia química, sem que ocorra a produção de gases poluentes nocivos ao meio ambiente.
Questão 5
A composição média de uma bateria automotiva esgotada é de aproximadamente 32% Pb, 3% PbO, 17% PbO2 e 36% PbSO4. A média de massa da pasta residual de uma bateria usada é de 6kg, onde 19% é PbO2, 60% PbSO4 e 21% Pb. Entre todos os compostos de chumbo presentes na pasta, o que mais preocupa é o sulfato de chumbo (II), pois nos processos pirmometalúrgicos, em que os compostos de chumbo (placas das baterias) são fundidos, há a conversão de sulfato em dióxido de enxofre, gás muito poluente.
Para reduzir o problema das emissões de SO2, a indústria pode utilizar uma planta mista, ou seja, utilizar o processo hidrometalúrgico, para a dessulfuração antes da fusão do composto de chumbo. Nesse caso, a redução de sulfato presente no PbSO4 é feita via lixiviação com solução de carbonato de sódio (Na2CO3) 1M a 45ºC, em que se obtém o carbonato de chumbo (II) com rendimento de 91%. Após esse processo, o material para a fundição pra obter o chumbo metálico:
PbSO4 + Na2CO3 → PbCO3 + Na2SO4
Dados: massas molares em g/mol, Pb=207; S=32; Na=23; O=16; C=12
Segundo as condições do processo apresentado para a obtenção de carbonato de chumbo (II) por meio da lixiviação por carbonato de sódio e considerando uma massa de pasta residual de uma bateria de 6kg, qual quantidade aproximada, em quilogramas, de PbCO3 que é obtida?
a) 1,7 kg
b) 1,9 kg
c) 2,9 kg
d) 3,3 kg
e) 3,6 kg
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!