Acidos e Bases Combinadas 'conversando entre si' podem produzir o Equilíbrio Iônico. Parece estranho, mas é verdade. Relembre tudo sobre Equilíbrio Iônico no resumo para gabaritar questões de Química no vestibular e no Enem.
É hora de recuperar o conteúdo sobre Equilíbrio Iônico, sobre as Ligações Iônicas, de Solução Tampão, e também das Camadas de Valência dos elétrons. São temas básicos para você não se perder nas as questões de Química no vestibular e no Enem.
Uma boa dica para você começar é relembrar das aulas de Equilíbrio Iônico é matar a saudade das fórmulas e equações clássicas de Ácidos e Bases, das interações onde é possível conseguir o Equilíbrio Iônico, e da Solução Tampão.
O que é a Solução-Tampão
Veja agora com a professora de química Larissa Campos, do canal do Curso Enem Gratuito, as dicas básicas para você resolver questões de Solução-Tampão. Elas são essenciais para a sobrevivência e bom funcionamento do corpo humano:
Como você acompanhou no resumo em vídeo, uma Solução-Tampão, vamos por partes: Solução é uma mistura homogênea. E, quando esta Solução é resistente às variações de pH quando ocorre a entrada de um produto ou composto na solução original.
E, você pode encontrar soluções tamponantes básicas, e soluções tamponantes ácidas. A solução tamponante pode ser feita de um Ácido Fraco, e do seu sal correspondente.
Ou, ao contrário, uma solução pode ser feita com a Base Fraca, e o seu sal correspondente. Ambas funcionam de maneira a “equilibrar” para que não ocorra uma grande variação no pH.
O que é o Equilíbrio Químico
Acompanhe agora com o professor de química Felipe Sobis, do canal do Curso Enem Gratuito, uma introdução básica sobre o que é o Equilíbrio Químico. É um tema certo na química do Enem:
Aprenda no vídeo acima com o professor Sobis que o Equilíbrio Químico acontece nas reações reversíveis. Por exemplo, quando uma reação a+b = c+d, e, sendo que ao mesmo tempo c+d = a+b, temos uma reação reversível.
Pois se a+b são os reagentes na primeira equação, gerando o produto c+d, e se o contrário também ocorre, temos uma reação de Equilíbrio Químico.
Veja as fórmulas clássicas do Equilíbrio Iônico
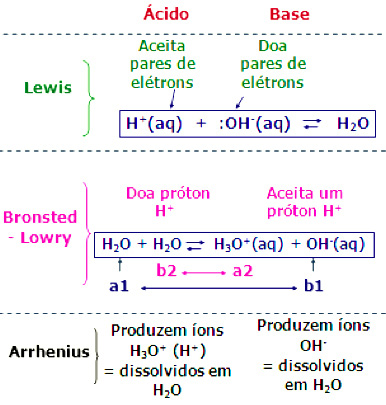
Você lembra da da Reação de Autoionização da água?
- Confira aqui: H2O + H2O H3O+(aq) + OH–(aq)
- No equilíbrio iônico: [H3O+] = [OH–] = 1,0 x 10-7 mol/L 25ºC
O que é uma Reação Iônica
Confira agora com a professora Larissa Campos os fundamentos para as Reações Iônicas, e que envolvem o conhecimento sobre as camadas de valência completas ou incompletas dos diferentes átomos.
O Hélio, por exemplo, tem dois elétros. Os outros gases nobres possuem oito elétrons ali. Confira agora na introdução da professora Larissa:
.
Veja como chegar à Constante de Ionização:
- Kw = [H3O+] [OH–]
- Kw = 1,0 x 10-14 25 ºC = Constante de Ionização da Água
O Equilíbrio ácido-base
- Solução neutra: [H3O+] = [HO–]
- [H3O+] = 1,0 x 10-7
- [HO–] = 1,0 x 10-7
Equilíbrio Iônico
- Solução ácida: [H3O+] > [OH–]
- [H3O+] > 1,0 x 10-7 mol/L
- [OH–] < 1,0 x 10-7 mol/L
- Solução básica: [H3O+] < [OH–]
- [H3O+] < 1,0 x 10-7 mol/L
- [OH–] > 1,0 x 10-7 mol/L

A Escala de pH
Concentração de íons H+ = expressa em termos do negativo do logaritmo decimal de sua concentração (mol/L) = pH
- pH = – log[H3O+]
- pOH = – log[HO–]
- pH da água neutra a 25 °C:
- pH = pOH = 7,0 (meio neutro)
pH em soluções ácidas:
[H+] > 1.0 ´ 10-7; pH < 7,0.
- pH em soluções básicas:
- [H+] < 1.0 ´ 10-7; pH > 7,0.
- -logKw = -log[H3O+] -log[OH–]
- pKw = pH + pOH
- pH + pOH = 14,00
- Os Ácidos fortes
- HCl(aq) + H2O(aq) → H3O +(aq) + Cl–(aq)
- HCl em água= ácido forte (100 % ionizado)
- As Bases fortes
- NaOH(s) → Na+(aq) + HO–(aq)
- NaOH em água = base forte (100% dissociado)
- Os Ácidos fracos
- HA(aq) + H2O(l)
 H3O+(aq) + A–(aq)
H3O+(aq) + A–(aq)  Ka=contante de dissociação do ácido
Ka=contante de dissociação do ácido- pKa=-logKa
- As Bases fracas
- NH3(aq) + H2O(l)
 NH4+(aq) + OH–(aq)
NH4+(aq) + OH–(aq)
A constante de dissociação da base (Kb):
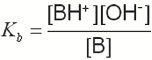 pKb=-logKb
pKb=-logKb
Relação entre Ka e Kb

Ácido: HA + H2O 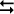 H3O+ + A– Ka
H3O+ + A– Ka
Base conjugada:
H2O + A– 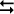 HA + OH– Kb
HA + OH– Kb
2H2O H3O+ + OH– KW = Ka x Kb
pKa + pKb = pKW
Quanto mais forte for o ácido, mais fraca a base conjugada.
Indicadores ácido-base – são normalmente substâncias orgânicas de alto peso molecular, que mudam de cor em certa faixa de pH (chamado faixa de viragem do indicador).
Exemplo 1: Fenolftaleína (pH 8-10)
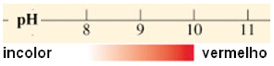
Exemplo 2 – Alaranjado de metila (pH 3,1-4,4)
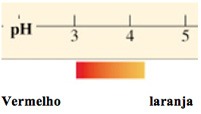
Indicadores universais – papel de tornassol – ampla faixa de viragem, é possível observar mudança de cor em vários pHs e ter ideia aproximada do valor deste pela cor do papel.
pH-metro – o pH é medido eletronicamente
Veja o que é uma Solução Tampão
- Uma solução tamponada resiste a uma mudança no pH quando ácidos ou bases são adicionados, ou quando ocorre uma diluição.
- Consiste numa mistura de um ácido fraco e sua base conjugada.
Equação de Henderson-Hasselbalch
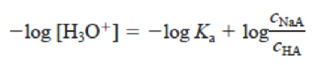
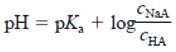
Desafios sobre Equilíbrio Iônico
Questão 1
Sabemos que o pH da água pura a 25ºC é igual a 7. Porém, as constantes de equilíbrio são alteradas com a temperatura, logo que a densidade e o número de mols da água por litro é alterado também. Considerando os valores da constante de ionização da água em função da temperatura:
|
Temperatura (K) |
Kw |
|
298 |
1 x 10-14 |
|
323 |
5,3 x 10-14 |
Podemos afirmar que na água pura:
a) [H+] = [OH–] a qualquer temperatura
b) [OH-] > 1 x 10-7 a 298 K
c) [H+] < 1 x 10-7 a 298 K
d) [OH-] < 1 x 10-7 a 323 K
e) [H+] < 1 x 10-7 a 323 K
Dica 1 – Tire todas as suas dúvidas e fique preparado para a prova de Química Enem com mais esta aula sobre o Equilíbrio Químico. – https://blogdoenem.com.br/equilibrio-quimico-quimica-enem/
Questão 2
Para evitar que os meninos continuem urinando nas piscinas que devem estar em pH neutro, vem sendo usado um indicador na água, que passa de incolor para vermelho vivo no momento em que a acidez aumenta pela adição de ácido úrico. Considerando-se o volume de 4,5 litros de água de uma piscina atingindo por meio litro de urina contendo H+ na concentração 10-3 mol/L, a variação de pH será aproximadamente:
a) 1 unidade.
b) 2 unidades.
c) 3 unidades.
d) 4 unidades.
e) n.d.a.
Dica 2 – Estude sobre os fatores que influenciam uma reação química e a Natureza dos Reagentes em mais uma aula preparatória para a prova de Química Enem – https://blogdoenem.com.br/natureza-dos-reagentes-quimica-enem/
Questão 3
A água mineral gasosa contém gás carbônico dissolvido na sua composição, sabe-se que a solubilidade dos gases em geral à temperatura ambiente é baixa, portanto, a alta taxa de CO2(g) presente é causada pelo aumento da pressão durante o engarrafamento. Ao abrir uma garrafa, estamos igualando a pressão do seu interior com a pressão ambiente, por esse motivo a maior parte do gás dissolvido é expelido da solução.
Com base no enunciado e sabendo que o gás carbônico é um óxido de caráter ácido, podemos dizer que o pH da água mineral, após aberta em relação à garrafa fechada:
a) Diminui.
b) Aumenta.
c) Iguala-se a 0.
d) Não se altera.
e) Iguala-se a 7.
Dica 3 – Que tal revisar tudo sobre Cinética Química e garantir a sua nota na prova de Química Enem? Estude com a gente para o Exame Nacional do Ensino Médio! – https://blogdoenem.com.br/cinetica-quimica-enem/
Questão 4
Durante uma erupção vulcânica, são expelidos inúmeros gases na atmosfera, dentre eles, temos o SO2 (dióxido de enxofre), SO3 (trióxido de enxofre) e CO2 (gás carbônico), em relação a esse fenômeno podemos afirmar EXCETO:
a) A acidez das chuvas aumentou durante um período.
b) Os gases emitidos pela erupção vulcânica poluíram a atmosfera.
c) A erupção decorrida pode ser considerada como um processo exotérmico.
d) O pH das chuvas será menor durante um certo período naquela região.
e) A fauna e a flora da região próxima ao vulcão será renovada.
Questão 5
O pH do sangue é estreitamente regulado dentro de uma faixa que vai de 7,35 a 7,45. O pulmão, através do processo da respiração, é um dos atuantes na regulação do ácido carbônico presente no sangue. O rim é outro atuante, podendo reabsorver bicarbonato üHCO–3ü, produzir prótons üHüü e produzir ou consumir íons de amônio üNHü4ü. Considere o equilíbrio que acontece no sangue:
CO2ügüÜ H2Oüü Hü üaqüü HCO–3
Com base no exposto, é CORRETO afirmar que:
a) o aumento da concentração de gás carbônico leva a um aumento do pH do sangue.
b) a ingestão de bicarbonato de sódio deslocaria o equilíbrio para a direita se não fosse o efeito tamponante do sangue.
c) o aumento da frequência respiratória produz uma maior concentração de gás carbônico no sangue.
d) a reabsorção de bicarbonato pelo rim contribui para a diminuição do pH.
e) a retirada de gás carbônico durante o processo de respiração evita a diminuição do pH.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!
 H3O+(aq) + A–(aq)
H3O+(aq) + A–(aq)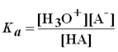 Ka=contante de dissociação do ácido
Ka=contante de dissociação do ácido NH4+(aq) + OH–(aq)
NH4+(aq) + OH–(aq)
