Porque os átomos realizam ligações? Segundo a Teoria ou Regra do Octeto, criada por Gilbert Newton Lewis, químico estadunidense e Walter Kossel, físico alemão, um átomo adquire estabilidade quando possui 8 elétrons na camada de valência (camada eletrônica mais externa), ou 2 elétrons quando possui apenas uma camada. Para tanto, o átomo procura sua estabilidade doando ou compartilhando elétrons com outros átomos, donde surgem as ligações químicas.
Agora que você já relembrou porque os átomos se ligam, vamos ver quais tipos de ligações eles realizam?
Ligações iônicas
É o tipo de ligação que se da por meio da atração de íons de cargas opostas. Em geral, a um átomo que tende a ceder elétrons (metal), constituindo o cátion, e outro que tende a receber os elétrons ( não metal), ânion.
Veja o caso do cloreto de sódio:
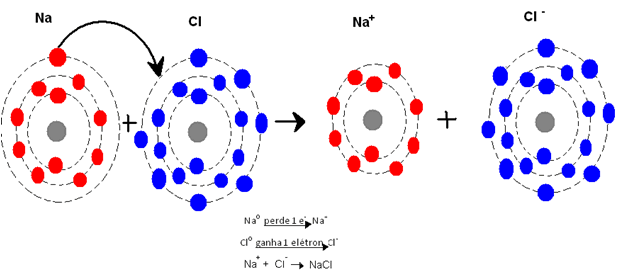
Para que o sódio (Na) atinja a sua estabilidade, ou seja, tenha 8 elétrons na última camada, é necessário que perca seu último elétron. Para que o mesmo aconteça com o cloro (Cl), é preciso que ele aumente em 1 seu número de elétrons da última camada, ou seja, ganhe 1 elétron. Quando isso acontece forma-se os íon, pois o número de elétrons desses elementos fica diferente do número de prótons. Portanto, na ligação iônica temos sempre uma transferência de elétrons.
Podemos indicar o processo que origina a ligação iônica usando a notação de Lewis:
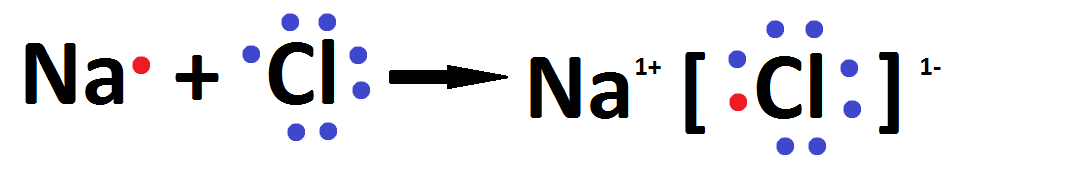
O cloreto de sódio também pode ser representado por sua fórmula iônica:
Na+ Cl–
Após a ligação, os elementos químicos são os mesmo e, portanto, os mesmos símbolos, já que não houve alteração de seu núcleo atômico.
Ligação covalente ou molecular
É a ligação que se dá por compartilhamento de par de elétrons, os elétrons da ligação passam a pertencer aos dois átomos ligados. Quando dois átomos estão unidos por uma ligação covalente são chamados de molécula.
Como se da essa ligação? Vamos ver um exemplo:
O gás cloro é uma substância simples formada pelo elemento cloro, do grupo 17.
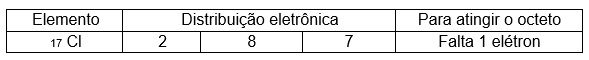
Na ligação entre dois átomos de cloro, ambos precisam de 1 elétron para se estabilizar, forma-se um par de elétrons para o qual cada um dos átomos de cloro fornece um elétron, que passa a ser compartilhado pelos dois átomos.
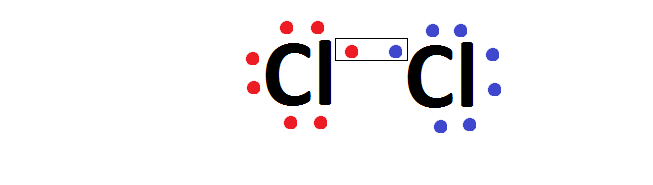
Após a ligação, o par de elétrons, passa a pertencer aos dois átomos, que, então, passam a ter 8 elétrons cada um no último nível. O conjunto formado passa a ser a molécula de cloro e é eletricamente neutra, isto é, não possui cargas positivas ou negativas e como não houve transferência de elétrons, não há íons.
Além da formula de Lewis, usamos a fórmula estrutural, em que cada par eletrônico comum é representado por um traço (-), e a fórmula molecular, no qual o símbolo é acompanhado do número de átomos que participa da molécula.

Resumindo…
Metais com Não-Metais = Ligação Iônica.
Não-Metais com Não-Metais = Ligação Covalente.
Ligação Iônica = Transferência definitiva de elétrons, formação de íons.
Ligação Covalente = Compartilhamento do par de elétrons.
Termine sua revisão sobre as ligações químicas com o vídeo abaixo, gravado pelo prof. Sobis:
Para finalizar sua revisão, que tal testar o seu conhecimento?
1- (Mack) Na ligação entre átomos dos elementos químicos 15P31 e Ca, que tem 20 prótons, forma-se o composto de fórmula:
a) CaP
b) Ca3P
c) CaP3
d) Ca2P3
e) Ca3P2
Resolução
A primeira coisa que você deve fazer é a distribuição eletrônica para os átomos de P e Ca, veja abaixo como fica.
15P: 1s2 2s2 2p6 3s2 3p3
20Ca: 1s2 2s2 2p6 3s2 3p6 4s2
O P possui 5 elétrons na camada de valência (em vermelho), sendo assim para atingir o octeto completo precisa ganhar três elétrons. Já o Ca possui 2 elétrons na camada de valência, então pode doar dois elétrons para atingir o octeto completo (camada anterior). Para formar o composto entre esses dois elementos químicos, o número de elétron perdido e ganho tem que ser o mesmo, desta maneira temos que ter dois átomos de P e três de Ca,
1 átomo de P ganha três elétrons-> 2 átomo de P ganham seis elétrons;
1 átomo de Ca perde dois elétrons – > 3 átomos de Ca perdem seis elétrons;
assim temos o balanço de carga e a alternativa que contém o composto correto é a letra e ( Ca3P2).