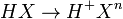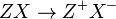Veja como o sueco Svante Arrhenius criou as definições de Ácidos, Bases e Sais. Confira as classificações e denominações e perceba como estes produtos estão no dia a dia de nossas casas e na indústria. Assim você grava e não esquece. Revisão de Química para Enem e Vestibular. Confira abaixo.
Um dos personagens mais importantes nas definições criadas para a Química foi o sueco Svante Arrhenius. Ele ganhou o Prêmio Nobel de 1903 em reconhecimento às teorias desenvolvidas para identificar e classificar Ácidos, Bases, e Sais. Confira abaixo revisão sobre as Bases e os Sais.
Veja as definições clássicas de ácido, base e Sal, e depois uma aula especial sobre as Bases e os Sais.
- Ácidos: São denominados Ácidos as substâncias que em solução aquosa sofrem um processo de Ionização, quando corre a liberação de Hidrogênio na forma H+.
-

Ácidos
- Bases: São as substância que em solução aquosa passam por um processo de dissociação iônica, quando ocorre a liberação de íons de Hidroxila (OH) na forma de ânions. A Soda Cáustica, por exemplo, e uma ‘Base’ típica. Assim como o ‘Leite de Magnésia’, utilizado na forma líquida ou em pastilhas para neutralizar a acidez estomacal.
-

Bases
- Sais: São denominados como Sal as substâncias que em solução aquosa passam por processo de Dissociação Iônica em que pelo menos um cátion diferente do H+ é liberado, e que também é liberado ao menos um ânion diferente do OH–
-

Sal
Revisão sobre as Bases, dentro da formulação proposta por Arrhenius:
Como você já viu, Bases são substâncias que, em solução aquosa, sofrem dissociação liberando como único íon negativo o ânion hidroxila (HO–).
Exemplo: NaOH → Na+(aq) + HO–(aq)

Nomenclatura das Bases
Para bases onde o íon metálico possui apenas um estado de oxidação, ou seja, nox fixo. Nome do ânion de Nome do cátion. Exemplo:
NaOH – hidróxido de sódio
Al(OH)3 – hidróxido de alumínio
Para bases onde o íon metálico possui mais de um estado de oxidação, ou seja, nox variável. Nome do ânion de Nome do cátion seguido do número de oxidação do metal em romano. Ou,
Nome do ânion de Nome do cátion seguido do sufixo oso (menor estado de oxidação), e Nome do ânion de Nome do cátion seguido do sufixo ico (maior estado de oxidação).
Exemplos: Fe(OH)2 – hidróxido de ferro II ou hidróxido ferroso;
Fe(OH)3 – hidróxido de ferro III ou hidróxido férrico
Classificação das Bases
a) Quanto ao número de hidroxilas (HO-)
- monobases (monoprótica). 1 HO– Ex. NaOH
- dibases (diprótica). 2 HO– Ex. Ca(OH)2
- tribases (triprótica). 3 HO– Ex. Al(OH)3
- tetrabases (tetraprótica). 4 HO– Ex. Pb(OH)4
b) Quanto ao grau de dissociação
- base forte – quase 100% dissociado. Ex.: NaOH, KOH, Ca(OH)2 (hidróxidos de metais alcalinos e alcalinos terrosos).
- bases fracas – menos de 5% de dissociação. Ex.: NH4OH e hidróxidos dos metais em geral (exceto metais alcalinos e alcalinos terrosos).
c) Quanto à solubilidade em água
- solúveis – hidróxidos dos metais alcalinos. Ex. NaOH e NH4OH.
- pouco solúveis – hidróxidos dos metais alcalinos terrosos. Ex.: Ca(OH)2, Ba(OH)2, etc.
- praticamente insolúveis – todas as demais.
Utilização das Bases do dia a dia e na indústria química. Perceba que muitas delas são altamente corrosivas e tóxicas.
- Hidróxido de sódio (NaOH) – soda cáustica (usado para fabricação de sabão).
- Hidróxido de amônia – presente em muitos produtos de limpeza.
- Hidróxido de magnésio (Mg(OH)2) – “leite de magnésio”, usado para combater a acidez estomacal.

Sais
Os sais são compostos iônicos. Ou seja, são formados por íons positivos (cátions) e negativos (ânions) diferentes de H+ e HO–.
- Eles são óbitos através de uma reação de neutralização (reação ácido-base).
2 NaOH + H2SO4 → Na2SO4 + 2H2O
- Reação de um metal com ácido (corrosão ou oxidação do metal com liberação de gás hidrogênio (H2).
Mg + H2SO4 → MgSO4 + H2
– Reação de um óxido básico (óxido de metais alcalinos e alcalinos terrosos) e um óxido ácido (óxido de não-metais).
CO2 + CaO → CaCO3
A fórmula química de um sal é sempre representada usando em primeiro lugar o cátion e depois o ânion.
Nomenclatura dos Sais
Um sal é designado juntando o nome do ânion e o nome do cátion que o constituem, por esta ordem. O ânion toma um nome de acordo com a terminação do nome do ácido que lhes dá origem:

Usando a regra do número de oxidação
A terminação do nome do ânion depende do número de oxidação do seu átomo central:
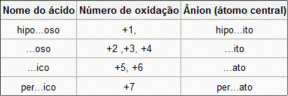
Ex.:
NaClO – hipoclorito de sódio.
Solubilidade dos Sais
- Solúveis
- todos os nitratos, cloratos e acetatos
- cloretos, brometos e iodetos excetos de Ag+, Hg22+, Pb2+
- sulfatos exceto de Ca2+, Sr2+, Ba2+, Pb2+
- Insolúveis
- sulfetos exceto de metais alcalinos, NH4+, Ca2+, Sr2+, Ba2+
Sais ácidos ou hidrogenossais
São obtidos a partir da neutralização parcial de diácidos ou poliácidos, ou seja, ainda existem hidrogênios ácidos.
Ex.: NaHCO3 – bicarbonato de sódio.
Sais básicos ou hidroxissais
São obtidos a partir da neutralização parcial de dibases ou polibases, ou seja, ainda existem hidroxilas para reagir.
Ex.: Ca(OH)Cl – mono-hidroxi-cloreto de cálcio.
Sal duplo ou misto
Ex.: NaNH4SO4 (sulfato duplo de sódio e amônio), CaBrCl (cloreto-brometo de cálcio).
Caráter
- Neutro – reação de uma base forte com um ácido forte. Ex.: NaCl
- Neutro – reação de uma base fraca com um ácido fraco. Ex.: NH4CN
- Ácido – reação de uma base fraca de um ácido forte. Ex.: NH4Cl
- Básico – reação de uma base forte e um ácido fraco. Ex.: NaCN
Utilização no dia a dia
- NaCl – cloreto de sódio – sal de cozinha.
- NaClO – hipoclorito de sódio – presente em alvejantes, águas sanitárias (como bactericida) e branqueadores de roupas.
- CaCO3 – carbonato de cálcio – presente no calcário, leite e águas duras.
- NaHCO3 – bicarbonato de sódio – é usado em antiácidos e no preparo de bolos (fermento químico).
- Na2SO4 – sulfato de sódio – fabricação de gesso, giz para quadro-negro, presente em águas com dureza permanente.
- MaSO4 – sulfato de magnésio – é usado como purgante, fabricação de gesso em ortopedia ou em construção.
Cuidados – muitos sais são altamente tóxicos.
Sais solúveis de Ba e de muitos metais de transição são extremamente tóxicos.

Sal de cozinha (NaCl)
Saiba mais sobre Ácidos e Bases nesta aula do canal Curso Enem Gratuito, disponível no Youtube. Após assistir, revise o que você aprendeu respondendo aos nossos desafios!
Desafios para você resolver e compartilhar
Questão 1
A azia (acidez estomacal excessiva) resulta de um descontrole alimentar ou funcional onde excesso de ácido é liberado no estômago. A fim de diminuir esse excesso de ácido é mais aconselhável beber um pouco de água contendo:
a) suco de limão
b) bebida alcoólica
c) vinagre
d) leite de magnésio (hidróxido de magnésio)
e) suco de laranja
Dica 1 – Revise sobre Funções inorgânicas em mais esta aula preparatória para a prova de Química Enem. Estude com a gente para o Exame Nacional do Ensino Médio! – https://blogdoenem.com.br/funcoes-inorganicas-quimica-enem-2/
Questão 2
O papel sulfite, ou sulfito, tem esse nome pois na última etapa do tratamento do papel é utilizado sulfito de sódio (Na2SO3). Uma das formas de obter esse sal é através da reação de neutralização do ácido sulfuroso (H2SO3) com:
a) NaCl
b) Na2SO4
c) NaOH
d) NaHSO3
e) Na(OH)2
Dica 2 – Relembre sobre os princípios da Estequiometria em mais esta aula de revisão para a prova de Química Enem. Pronto para o Exame Nacional do Ensino Médio? – https://blogdoenem.com.br/estequiometria-quimica-enem/
Questão 3
Na primeira etapa do tratamento das águas para o abastecimento público, ocorre a mistura de sulfato de alumínio e hidróxido de cálcio, para promover a coagulação de partículas na câmara de floculação. Nessa reação, ocorre a troca de ânions para formarem compostos pouco solúveis em água. Sendo assim, os produtos dessa reação são:
a) AlOH e CaSO4
b) Al3OH e Ca2SO4
c) AlOH e CaS
d) Al(OH)3 e Ca2SO4
e) Al(OH)3 e CaSO4
Dica 3 – É fácil medir o peso de qualquer coisa, mas como podemos medir o peso de um átomo? Saiba tudo sobre as Grandezas Químicas nesta aula de Química Enem – https://blogdoenem.com.br/grandezas-quimicas-quimica-enem/
Questão 4
O oxigênio é um elemento químico altamente reativo, reagindo com quase todos os elementos químicos. Dentre os principais compostos formados pelo oxigênio, destacam-se os óxidos ácidos, óxidos básicos e óxidos anfóteros. Qual das afirmativas abaixo apresenta exemplos desses óxidos na mesma ordem que foram citados.
a) NaO; CO2 e CO
b) CO2 ; CaO e Al2O3
c) CaCO3; CaO e Al2O3
d) CaO; CO2 e CO
e) CO; CO2 e CaO
Questão 5
(UDESC)
O leite de magnésio é uma suspensão de Mg(aq)(OH)2(s) em água. Esta suspensão dissolve-se com a adição de HCl(aq), gerando uma solução final aquosa incolor que contém cloreto de magnésio. As funções químicas das substâncias Mg(OH)2, HCl e cloreto de magnésio, respectivamente, são:
a) óxido, ácido e base
b) óxido, ácido e sal
c) base, ácido e óxido
d) sal, ácido e óxido
e) base, ácido e sal
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!