Entenda como identificar o Grau de Pureza dos Reagentes e o Rendimento das Reações Químicas. Tudo começa com as Leis Ponderais de Proust, e com o Postulado de Lavoisier. Veja agora:
O que é o Cálculo Estequiométrico? – Os cálculos estequiométricos fazem uso das leis ponderais de Proust (proporções fixas), e da Lei de Lavoisier (o postulado de Conservação das Massas: Na natureza nada se cria, nada se perde. Tudo se transforma).
O Cálculo Estequiométrico
A razão de ser do Cálculo Estequiométrico está relacionada com a finalidade de prever massa, número de mol, volume ou até número de moléculas formado ou utilizado em uma reação química.
Esta aula trata de situações possíveis em cálculos estequiométricos como presença de impurezas e rendimento da reação. São situações que colocam esses cálculos mais perto da realidade das indústrias, laboratórios e outros segmentos já que dificilmente um reagente é utilizado na sua forma pura e os processos utilizados em laboratório apresentam certa ineficiência.
Confira agora um resumo de introdução tema do Cálculo Estequiométrico, com a professora Larissa, do canal do Curso Enem Gratuito.
As dicas da professora Larissa:
- O grau de pureza dos reagentes é a relação entre a massa da substância pura e a massa total da amostra.
- A porcentagem de pureza (%) é a porcentagem da massa da substância pura em relação à massa total da amostra.
- Você deve trabalhar este tema empregando o cálculo estequiométrico, acertando os coeficientes da equação química e calculando a massa de produto obtido.
- Em seguida, através de regra de três, determinar o grau de pureza.
- Quando não é citado o valor da pureza, considera-se igual a 100%.
Grau de Pureza dos reagentes
Quando o problema informar a pureza do reagente, devemos extrair essa parte pura, e posteriormente determinar o que a questão pede. Confira no Exemplo:
Determine a massa de trióxido de enxofre (SO3) produzida na combustão de 160 gramas de dióxido de enxofre (SO2) que apresenta 80% de pureza.
- 1º Passo: extrair a massa real de dióxido de enxofre.
- 160 gramas SO2 ________ 100%
- x gramas SO2 _______ 80%
- x = 128 gramas de SO2
- massa reagente = 128 gramas
- massa impureza = 32 gramas
- 2º Passo: prever a massa de SO3 produzida.
- SO2(g) + ½ O2(g) → SO3(g)
- 64 gramas__________ 80 gramas
- 128 gramas__________ x gramas
- Resultado: x = 160 gramas
Rendimento da Reação
Confira agora o resumo completo sobre o Rendimento das Reações Químicas na aula de introdução da professora Larissa:
As dicas da professora Larissa:
- Geralmente estudamos exemplos de fenômenos ideais para simplificar os estudos em química.
- Porém, uma reação química não pode ser considerada como um sistema ideal. Isso porque não podemos prever a quantidade de produto que será formada a partir dessa reação com exatidão.
- Vários fatores difíceis de serem controlados podem estar envolvidos em um processo laboratorial, e estes fatores podem contribuir para que a reação química não alcance o rendimento calculado na teoria.
- O rendimento de uma reação química é a relação entre a quantidade realmente obtida de produto e a quantidade teoricamente calculada.
- Nesta aula acima, a professora Larissa te ensina a calcular o rendimento de uma reação química.
Exemplos de cálculo do Rendimento da Reação Química
Quando o problema não informar o rendimento da reação, devemos considerá-lo igual a 100%. Caso o rendimento da reação for informado devemos corrigir as quantidades previstas. Veja no Exemplo:
Determine a massa de trióxido de enxofre (SO3) produzida na combustão de 160 gramas de dióxido de enxofre (SO2) que apresentou um rendimento de 40%.
- 1º Passo: prever a massa de trióxido de enxofre produzida.
- SO2(g) + ½ O2(g) → SO3(g)
- 64 gramas__________ 80 gramas
- 160 gramas__________ x gramas
- x = 200 gramas
- 2º Passo: corrigir a massa de produto obtida considerando um rendimento de 40%. A massa obtida corresponde a um rendimento de 100%.
- 200 gramas _____ 100% rendimento
- x gramas _______ 40% rendimento
- x = 80 gramas de SO3
Resumo final de Estequiometria
Veja com o professor Felipe Sobis, do canal do Curso Enem Gratuito, como é simples de aprender os fundamentos que você precisa para mandar bem na Química do Enem.
Você sabe calcular a quantidade de produto formada em uma reação química? Estequiometria é o cálculo que permite relacionar as quantidades de reagentes e produtos, que participam de uma reação química, com o auxilio da reação química correspondente. Veja:
Mandou muito bem o professor Felipe Sobis!
Desafios sobre o Cálculo Estequiométrico
Questão 01
No processo de produção do ferro, a sílica é removida do minério por reação com calcário (CaCO3).
Sabe-se, teoricamente (cálculo estequiométrico), que são necessários 100 g de calcário para reagir com 60 g de sílica.
Dessa forma, pode-se prever que, para a remoção de toda a sílica presente em 200 toneladas do minério na região 1, a massa de calcário necessária é, aproximadamente, em toneladas, igual a:
a) 1,9.
b) 3,2.
c) 5,1.
d) 6,4.
e) 8,0.
Questão 02
Determinada Estação trata cerca de 30.000 litros de água por segundo. Para evitar riscos de fluorese, a concentração máxima de fluoretos nessa água não deve exceder a cerca de 1,5 miligrama por litro de água.
A quantidade máxima dessa espécie química que pode ser utilizada com segurança, no volume de água tratada em uma hora, nessa Estação, é:
a) 1,5 kg.
b) 4,5 kg.
c) 96 kg.
d) 124 kg.
e) 162 kg.
Questão 03
O esquema ilustra o processo de obtenção do álcool etílico a partir da cana-de-açúcar.
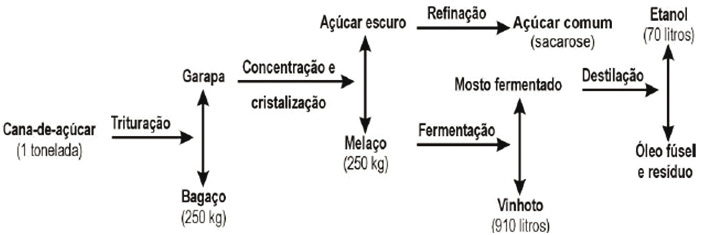
Em 1996, foram produzidos no Brasil 12 bilhões de litros de álcool. A quantidade de cana-de-açúcar, em toneladas, que teve de ser colhida para esse fim foi aproximadamente.
a) 1,7×108.
b) 1,2×109.
c) 1,7×109.
d) 1,2×1010.
e) 7,0×1010.
Questão 04
Em setembro de 1998, cerca de 10.000 toneladas de ácido sulfúrico (H2SO4) foram derramadas pelo navio Bahamas no litoral do Rio Grande do Sul. Para minimizar o impacto ambiental de um desastre desse tipo, é preciso neutralizar a acidez resultante. Para isso pode-se, por exemplo, lançar calcário, minério rico em carbonato de cálcio (CaCO3), na região atingida.
A equação química que representa a neutralização do H2SO4 por CaCO3, com a proporção aproximada entre as massas dessas substâncias é:
|
H2SO4 |
+ |
CaCO3 |
→ |
CaSO4 |
+ |
H2O |
+ |
CO2 |
|
1 tonelada |
reage com |
1 tonelada |
sólido sedimentado |
gás |
Pode-se avaliar o esforço de mobilização que deveria ser empreendido para enfrentar tal situação, estimando a quantidade de caminhões necessária para carregar o material neutralizante. Para transportar certo calcário que tem 80% de CaCO3, esse número de caminhões, cada um com carga de 30 toneladas, seria próximo de:
a) 100.
b) 200.
c) 300.
d) 400.
e) 500.
Questão 05
Na análise de uma amostra biológica para análise forense, utilizou-se 54 g de luminol e peróxido de hidrogênio em excesso, obtendo-se um rendimento final de 70%. Sendo assim, a quantidade do produto final (IV) formada na reação foi de:
a) 123,9.
b) 114,8.
c) 86,0.
d) 35,0.
e) 16,2.
Você consegue resolver estes exercícios de Cálculo Estequiométrico?
Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!



