Veja um resumo com aula gratuita para você lembrar como se faz o cálculo de pH e de pOH de uma solução de ácidos fortes e bases. Faça revisão com aula da Khan Academy e mande bem nas provas dos vestibulares e do Enem. Confira abaixo aula gratuita com exercícios.
Ácidos e Bases – Aprenda a fazer o cálculo de pH e pOH e não vacile nas questões de Química no Vestibular e no Enem. Confira.
Limão x Banana Verde – O que tem a ver com Ácido e Base? – Existem em nosso cotidiano substâncias que apresentam sabor azedo, tais como o suco de limão e o vinagre, e outras que apresentam sabor adstringente, ou seja, que “amarram, que travam a boca”, é o caso da banana quando está verde. ![]() Na verdade esses dois tipos de sabor, caracterizam dois grupos e substâncias: Os ácidos e as bases. Limão está para Ácido assim como banana verde está para Base. Você já deve ter escutado alguém dizer que se deve fazer sempre o cálculo de pH da água de uma piscina, e que precisa sempre ser controlado.
Na verdade esses dois tipos de sabor, caracterizam dois grupos e substâncias: Os ácidos e as bases. Limão está para Ácido assim como banana verde está para Base. Você já deve ter escutado alguém dizer que se deve fazer sempre o cálculo de pH da água de uma piscina, e que precisa sempre ser controlado.
Ou, então já ouviu que o pH da água de um aquário ou de um solo, para favorecer um determinado plantio também precisa ser controlado ou corrigido. Até mesmo nosso sangue deve manter um pH sempre entre os valores de 7,35 e 7,45. Uma variação de 0,4 no pH do nosso sangue pode ser fatal!
Você sabe exatamente o que é o pH e o que significam seus valores? Ainda não? Então, é hora de aprender, porque o cálculo de pH sempre cai no Enem e nos vestibulares. 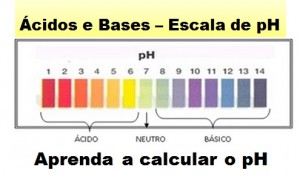 Veja o que é o pH – O Potencial Hidrogeniônico (pH) consiste num índice que indica a acidez, neutralidade ou alcalinidade de um meio qualquer. As substâncias em geral, podem ser caracterizadas pelo seu valor de pH , sendo que este é determinado pela concentração de íons de Hidrogênio (H+).
Veja o que é o pH – O Potencial Hidrogeniônico (pH) consiste num índice que indica a acidez, neutralidade ou alcalinidade de um meio qualquer. As substâncias em geral, podem ser caracterizadas pelo seu valor de pH , sendo que este é determinado pela concentração de íons de Hidrogênio (H+).
Dica: Quanto menor o pH de uma substância, maior a concentração de íons H+ e menor a concentração de íons OH–.
Arrhenius, você conhece? – O químico sueco Svante Arrhenius (1859-1927), fundamentado em experiências de condutividade elétrica propôs em 1887 as seguintes definições para identificação dos ácidos e bases: 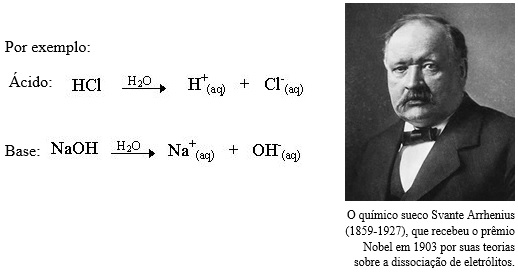 O químico Svante Arrhenius estabeleceu os ácidos como substâncias que – em solução aquosa – liberam íons positivos de hidrogênio (H+), enquanto as bases, também em solução aquosa, liberam hidroxilas, íons negativos (OH–).
O químico Svante Arrhenius estabeleceu os ácidos como substâncias que – em solução aquosa – liberam íons positivos de hidrogênio (H+), enquanto as bases, também em solução aquosa, liberam hidroxilas, íons negativos (OH–).
Propriedades dos Ácidos e Bases
– Os ácidos e bases apresentam algumas propriedades importantes que servem para comparar e distinguir. Cai muitas vezes no Enem e nos vestibulares. Veja as Propriedades dos Ácidos e Bases:
- Solubilidade em água: Os ácidos costumam ser bem solúveis em água, enquanto a maior parte das bases é insolúvel.
- Estrutura: Todos os ácidos são moleculares, enquanto as bases podem ser moleculares ou iônicas.
- Condutividade Elétrica: Todos os ácidos só conduzem corrente elétrica quando estão dissolvidos em água.
Saiba mais sobre os conceitos de pH e pOH com uma super videoaula do Curso Enem Gratuito. Não deixe de conferir!
Dica 1 – Se você está em dúvida se recorda direitinho o que Ácido, Base, e as diferentes Propriedades de Ácidos e Bases, dê uma paradinha aqui e revise os fundamentos neste post sobre as Funções Inorgânicas: Ácidos e Bases aqui
Então, gostou da aula do Kuadro? Agora, no desenho abaixo você pode conferir diferentes valores de pH para vários produtos do nosso cotidiano.
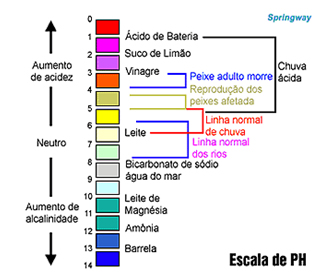
Como saber se uma solução é ácida ou básica? – Também é possível descobrir se uma solução é ácida ou básica, através dos indicadores de pH que são substâncias que mudam de cor na presença de íons H+ e OH– livres em uma solução. Leia mais sobre os indicadores no site: http://www.brasilescola.com/quimica/indicadores-ph.htm
Como calcular o pH e o pOH?
Agora, assista a vídeo da Khan Academy, traduzido para o Português pela Fundação Lemann, onde o professor Salman Khan explica como calcular o pH e o pOH de soluções de ácidos fortes e bases.
Veja o exemplo:
Qual o pH de (a) sangue humano, no qual a molaridade de íons H3O+ é igual a 4,0 x10-8 mol.L-1; (b) KOH (aq) 0,040 M.
Resolução: o pH é calculado a partir da equação: pH=-log[H3O+]. Para os ácidos fortes, a molaridade do H3O+ é igual a molaridade do ácido; para ácidos espera-se pH<7. Para bases fortes, primeiro encontre a molaridade de OH–, então converta para [H3O+] usando [H3O+] [OH–]=Kw. Então:
a) Para uma solução na qual a molaridade dos íons H3O+ é a 4,0 x10-8 mol.L-1 ,
pH=-log (4,0 x10-8 ) = 7,40
b) Cada fórmula unitária de KOH (uma base forte) fornece um íon OH–, então a molaridade de OH– é 0,040 mol.L-1 :
Consequentemente:
pH = -log (2,5×10-13 ) = 12,50
Dica do Blog – Veja o que mais cai em Química no Enem, e as principais dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Agora um desafio pra você!
PUC-RIO – O estômago produz suco gástrico constituído de ácido clorídrico, muco, enzimas e sais. O valor de pH no interior do estômago deriva, principalmente, do ácido clorídrico presente. Sendo o ácido clorídrico um ácido forte, a sua ionização é total em meio aquoso, e a concentração de H+ em quantidade de matéria nesse meio será a mesma do ácido de origem. Assim, uma solução aquosa de ácido clorídrico em concentração 0,01 mol L-1 terá pH igual a:
A) 2
B) 4
C) 5
D) 7
E) 9
Resposta: A
Dica 3 – Complete as suas revisões para o Enem e os vestibulares com as Apostilas Gratuitas que o Blog do Enem selecionou para você. Aulas, exercícios e dicas de todas as matérias. Tudo aqui: https://blogdoenem.com.br/category/apostila-enem/




