A Cinética Química é o estudo que determina as velocidades das reações químicas. Revise tudo sobre Cinética Química em mais uma aula de Química Enem
Cinética Química
É o estudo das velocidades e dos mecanismos das reações químicas. A velocidade da reação informa a rapidez do consumo dos reagentes, bem como a velocidade de produção dos produtos.
Cálculo da Velocidade da Reação
Considere a reação:
aA + cB → cC + dD
Para calcular a velocidade média de uma substância, utilizamos:
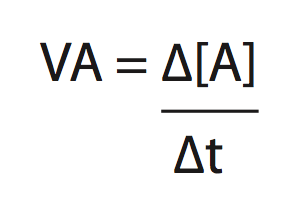
Para calcular a velocidade média de uma reação, utilizamos:
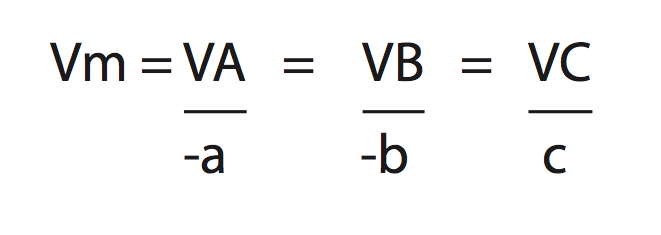
Considere a reação: 2A + 2B → C + 3D
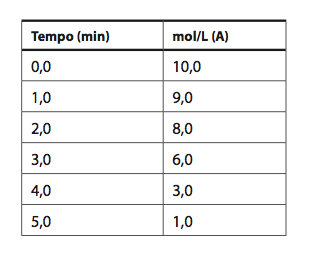
Considere um intervalo de tempo entre 0 e 3 minutos. A velocidade média de desaparecimento de A:
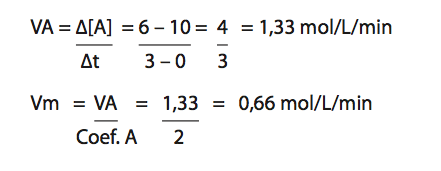
Energia de Ativação
É a energia mínima que as moléculas devem possuir para a formação do complexo ativado:
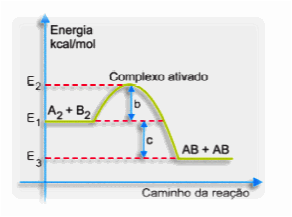
- b = energia de ativação
- c = ∆H da reação
- E2 = complexo ativado
- E1 = energia inicial da reação
- E3 = energia final da reação
Dica: entenda melhor a cinética química com nossas aulas para o Enem
Fatores que influenciam na velocidade da reação
Concentração dos reagentes
Aumentando a concentração do reagente, também conseguimos acelerar a reação (Lei de Guldberg- Waage).
Superfície de contato
Quanto mais intimidade o aluno tiver com a prova, maior a rapidez da reação. Se um dos reagentes for sólido, quanto mais particulado (pó), maior será a área de contato. Isso acelera a reação.
Temperatura
Quanto mais quente, mais rápida a transformação. Conforme o sistema reagente é aquecido, maior é a energia cinética molecular, aumentando o número de choques efetivos e a rapidez da reação.
Dica 2 – Saiba tudo sobre Propriedades Coligativas em mais uma aula de Química Enem e fique preparado para gabaritar no Exame Nacional do Ensino Médio – https://blogdoenem.com.br/propriedades-coligativas-quimica-enem/
Pressão
A pressão acelera a reação por causa da vontade que o candidato tem de ser universitário. Quanto maior a pressão, menor é o volume, maior é o número de choques efetivos e, consequentemente, mais acelerada fica a reação.
Catalisador
Podemos admitir que o vestibular nesta reação fun- ciona como o catalisador que acelera a reação, sem interferir no produto final.
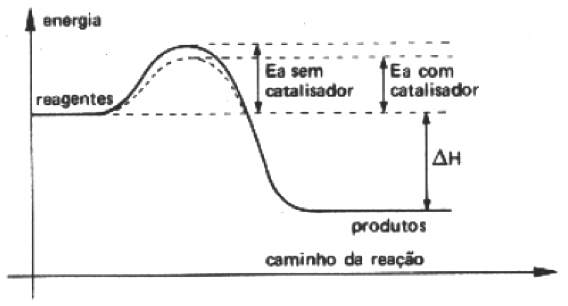
Tipos de catalisadores
Químicos: ácidos, bases, metais.
Biológicos: enzimas.
Saiba mais sobre Cinética Química nesta aula do canal Aulalivre.net, disponível no Youtube. Após assistir, revise o que você aprendeu respondendo aos nossos desafios!
[youtube http://www.youtube.com/watch?v=O2TCIa0ES0s&w=560&h=315]
Desafios
Questão 1
A obtenção de CO2 gasoso, em laboratório, pode ser feita pela reação entre carbonato de cálcio (sólido) e solução aquosa de ácido clorídrico.
Considere os conjuntos de condições experimentais descritas na tabela a seguir:
Utilizando-se uma certa massa de carbonato e excesso de ácido, obtém-se CO2 mais rapidamente quando se utiliza o conjunto de condições experimentais descrito em
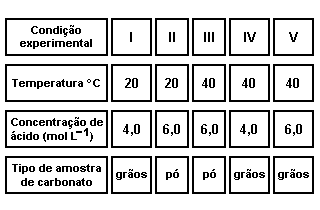
a) I.
b) II.
c) III.
d) IV.
e) V.
Questão 2
Considere as seguintes afirmações relativas a reações químicas ocorrendo sob as mesmas temperatura e pressão e mantidas constantes.
I. Uma reação química realizada com a adição de um catalisador é denominada heterogênea se existir uma superfície de contato visível entre os rea- gentes e o catalisador.
II. A velocidade de qualquer reação química é dependente da temperatura.
III. A energia de ativação de uma reação química realizada com a adição de um catalisador tem valor numérico maior do que o da reação não catalisada.
IV. A superfície de contato sendo maior permite uma maior velocidade de determinada reação.
V. Um dos produtos de uma reação química pode ser o catalisador desta mesma reação.
Das afirmações feitas, estão CORRETAS
a) apenas I e III.
b) apenas I e V.
c) apenas I, II e IV.
d) apenas I, II, IV e V.
e) apenas III, IV e V.
Dica 3 – Revise sobre o Processo de Separação de Misturas com mais esta aula de Química Enem e fique preparado para o Exame Nacional do Ensino Médio – https://blogdoenem.com.br/processos-de-separacao-de-misturas-quimica-enem/
Questão 3
X + 2Y → Z
Na reação acima equacionada, observou-se a variação na concentração de X em função do tempo, segundo a tabela a seguir:
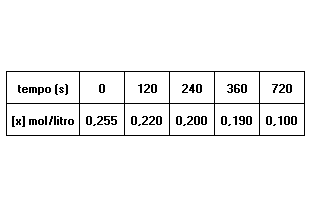
No intervalo de 4 a 6 minutos, a velocidade média da reação em mol/litro.min-1 é:
a) 0,010 b) 0,255 c) 0,005 d) 0,100 e) 0,200
Questão 4
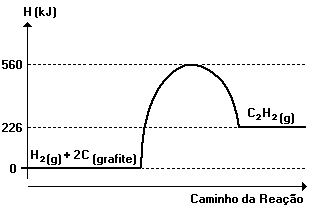
A partir do diagrama anterior, é INCORRETO afirmar que:
a) a entalpia das substâncias simples é igual a zero.
b) a energia fornecida ao carbono e ao gás hidrogênio na formação do complexo ativado é igual a 560kJ.
c) o ∆H deformação de um molde C2H2 é igual a + 226kJ.
d) a síntese do C2H2 é uma reação exotérmica.
e) na obtenção de dois mols de C2H2, o sistema absorve 452kJ.
Questão 5
A tabela a seguir mostra situações experimentais realizadas por um estudante sobre a reação:
Zn(s) + 2HCl(aq) ZnCl2(aq) + H2(g).
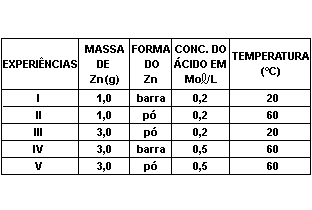
Assinale a experiência em que a reação entre o metal zinco e a solução de ácido clorídrico se processou com maior rapidez:
a) I
b) II
c) III
d) IV
e) V
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!

