A cinética radioativa é um assunto que aparece bastante na prova do Enem e dos vestibulares de todo Brasil. Que tal relembrar um pouco para gabaritar as questões de Química no Enem? O Blog do Enem preparou um super resumo para você mandar ver nessas provas!
Você já ouviu falar de datação por carbono 14? Ela é utilizada, por exemplo, para determinar a idade de restos biológicos muito antigos, como a idade da ossada de um hominídeo. Para entender essa técnica, você precisa entender um pouco sobre cinética radioativa, mais especificamente sobre desintegração radioativa.
Esse assunto pode aparecer não só em questões de química, mas também nas que envolvem história e também biologia. Quer saber mais sobre o assunto? Então, fique ligado(a) neste post que a professora Munique Dias preparou para você!

Desintegração radioativa, ou decaimento radioativo, é o nome dado ao fenômeno da transformação de um átomo em outro por meio da emissão de radiação a partir de seu núcleo instável. A cinética radioativa estuda a velocidade dessa desintegração atômica.
Os tipos de desintegração radioativa são:
- Decaimento alfa: Quando o núcleo de um átomo instável elimina uma radiação alfa, forma-se um novo núcleo (um novo átomo) cujo número atômico é duas unidades menor que o átomo de origem e o número de massa são quatro unidades menor que o átomo de origem.
- Decaimento beta: Quando o núcleo de um átomo instável elimina uma radiação beta, forma-se um novo núcleo (um novo átomo) cujo número atômico é uma unidade maior que o átomo de origem e o número de massa é o mesmo que o do átomo de origem.
- Decaimento gama: Como a radiação gama não apresenta massa e número atômico, quando um átomo a elimina de seu núcleo, permanece da mesma forma, ou seja, com o mesmo número de prótons e nêutrons em seu interior. Logo, a emissão de radiação gama não promove a transformação de um átomo em outro.
A velocidade de desintegração (V) de uma dada amostra de isótopos radioativos é proporcional ao número de núcleos radioativos da amostra(N):
V= K . N
Essa velocidade de desintegração também pode ser chamada de “atividade da amostra”. A atividade pode ser interpretada como o número de desintegrações radioativas que ocorrem em uma determinada unidade de tempo. As unidades mais utilizadas são o Bequerel e o Curie.
Bequerel (Bq) = 1 desintegrações/segundo
Currie (Ci) = 3,7.1010 desintegrações/segundo
A constante de decaimento (K) possui um valor definido para cada isótopo radioativo, como por exemplo:
226 Radio = ½ .1010 ano -1
232 Th = 1/2300 ano -1
Tempo de meia vida
Quando um radionuclídeo emite partículas alfa ou beta, ele se transforma, como sabemos, em outro nuclídeo diferente. Assim, à medida que o tempo passa, a quantidade de radionuclídeo vai diminuindo.
Tempo de meia vida ou período de semidesintegração (representado por t1/2) é o tempo necessário para que a metade da quantidade de átomos de um radionuclídeo presente em uma amostra sofra decaimento radioativo.
Quando a massa de um radioisótopo se reduz à metade, também se reduzem à metade o número de átomos, a quantidade em mols e a atividade radioativa (desintegrações por segundo) desse radioisótopo.
Importante!
O tempo de meia-vida é uma característica de cada radionuclídeo e não depende da quantidade inicial do radionuclídeo nem de fatores como pressão, temperatura e composição química do material (lembre-se de que radioatividade é um fenômeno nuclear, e não químico).
Datação por Carbono 14
A técnica da datação por Carbono 14 é utilizada para datar restos arqueológicos de origem biológica (como ossos, tecidos, madeira e fibras de plantas utilizadas na confecção de objetos) de até 50 mil anos.
Mas, o que é Carbono 14? O átomo de Carbono mais abundante na natureza é o chamado Carbono 12. Nesse tipo de átomo, o núcleo é composto por 6 prótons e 6 nêutrons. Já o Carbono 14 é um isótopo muito mais raro, cujo núcleo possui 6 prótons e 8 nêutrons. Esse isótopo é formado pelo choque de raios cósmicos (radiação proveniente do espaço na forma de nêutrons energizados) com átomos de Nitrogênio 14 (7 prótons e 7 nêutrons), que se transformam em um átomo de Carbono 14 e um de Hidrogênio (1 próton). Estes átomos de Carbono 14 combinam-se naturalmente com átomos de oxigênio e formam moléculas de gás carbônico. Sendo assim, são facilmente absorvidos pelas plantas e entram no ciclo do carbono dos seres vivos. Assim, todos os seres vivos acabam tendo uma certa taxa de Carbono 14 que se mantém equilibrada ao longo da vida e que é semelhante em todos os seres vivos.
Acontece que diferentemente do Carbono 12, o isótopo 14 é radioativo e se desintegra com o tempo. Seu tempo de meia vida é de 5700 anos. Assim que um organismo morre, ele para de absorver carbono. Sendo assim, ao longo do tempo, seus restos acabam perdendo Carbono 14 (pois estes se transformam novamente em nitrogênio através de decaimento beta). Dessa maneira, para datarmos um fóssil ou um resto arqueológico, podemos analisá-lo quimicamente e medir a quantidade de Carbono 14 presente, comparando-a com a dos seres vivos. Assim, quanto menos Carbono 14 tiver um resto em comparação com um ser vivo, mais velho ele será.
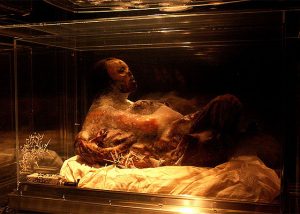
A imagem mostra uma múmia chamada de Juanita, encontrada na cordilheira dos Andes. Pela estrutura óssea acredita-se que Juanita teria aproximadamente 14 anos quando foi sacrificada em um ritual religioso. Através de datação por Carbono 14 sabe-se que Juanita vivei há aproximadamente 500 anos atrás.
E aí, aprendeu mais sobre cinética radioativa? Joia! Agora, para tirar todas as suas dúvidas, assista a esta videoaula sobre radioatividade e aprenda mais com o Curso Enem Gratuito! Não fique de fora dessa!
Agora, para finalizar sua revisão, que tal testar seu conhecimento? Você consegue resolver este exercício?
(Unirio-RJ) O elemento radioativo natural 90 Th 232, após uma série de emissões alfa e beta, isto é, por decaimento radioativo, converte-se em um isótopo não-radioativo, estável, do elemento chumbo, 82 Pb 208. O número de partículas alfa e beta, emitidas após o processo, é, respectivamente, de:
a) 5 e 2.
b) 5 e 5.
c) 6 e 4.
d) 6 e 5.
e) 6 e 6
Resposta: C