Você sabia que as soluções podem ser líquidas, sólidas e gasosas? Revise tudo sobre o Coeficiente de Solubilidade em mais uma aula de Química Enem. Confira abaixo.
Os Estados das Soluções – As soluções podem ser líquidas, sólidas ou gasosas. Por exemplo a Coca-Cola, é uma solução líquida porque todos os seus componentes estão dissolvidos na água constituindo uma mistura homogênea, ou seja, uma solução. Entenda este básico antes de entrar no assunto de Coeficiente de Solubilidade.
 A aliança de casamento, de ouro, ,é um exemplo de solução sólida. Uma aliança de ouro 18 quilates é uma mistura homogênea contendo 75% de ouro e 25% de cobre. O ar atmosférico (puro) é um exemplo de solução gasosa.
A aliança de casamento, de ouro, ,é um exemplo de solução sólida. Uma aliança de ouro 18 quilates é uma mistura homogênea contendo 75% de ouro e 25% de cobre. O ar atmosférico (puro) é um exemplo de solução gasosa.
Veja o que é Solubilidade
Confira agora com a professora de química Larissa Campos, do canal do Curso Enem Gratuito, um resumo rápido sobre Solubilidade e Densidade:
Os Componentes de uma solução:
- Soluto é a substância que está sendo dissolvida.
- Solvente é a substância que efetua a dissolução. A água é conhecida como solvente universal por ser a substância que dissolve a maior quantidade de solutos.
- Ex: NaCl(aq)= água é o solvente e NaCl é o soluto.
- H2SO4(aq) = água é o solvente e H2SO4 é o soluto.
- Obs: Solução aquosa é aquela que o solvente é a água.
Dica 1 – Preparado para o Exame Nacional do Ensino Médio? Relembre sobre as classificações das reações químicas e balanceamento de equações com esta de Química Enem – https://blogdoenem.com.br/reacoes-inorganicas-quimica-enem/ 
A Razão Soluto/Solvente
Dependendo da quantidade de soluto em relação à quantidade de solvente, as soluções podem ser diluídas, concentradas, saturadas ou supersaturadas. Veja:
• Diluída: Quando a quantidade de soluto é muito pequena em relação à do solvente.
• Concentrada: Quando a quantidade de soluto é grande em relação à do solvente.
• Saturada: Quando a quantidade de soluto é a máxima permitida para uma certa quantidade de solvente numa dada temperatura.
• Supersaturada: Quando a quantidade de soluto é maior que a máxima permitida. Daí então chamamos este sistema de sistema instável.
Tira-dúvidas de Produto e Solubilidade
A Dissolução
A dissolução corresponde à disseminação do sólido, sob a forma de partículas muito pequenas no meio líquido. Esse processo de dissolução ocorre porque o solvente tem a capacidade de quebrar a ligação entre os componentes do soluto e os rodeiam mantendo-os separados.
Exemplo de Dissolução: NaCl(s) → Na+(aq) + Cl-(aq)
O processo de dissolução depende dos seguintes fatores:
a) Concentração: A dissolução é tanto mais intensa quanto mais diluída é a solução. Isso significa que é mais fácil dissolver uma substância em água pura do que em água contendo algo já dissolvido.
b) Estado de subdivisão do sólido: A dissolução é tanto mais intensa quanto mais subdividido está o sólido.
c) Temperatura: De modo geral, a dissolução é mais intensa a temperaturas mais elevadas.
A Concentração da Soluções Químicas
Veja agora com o professor Felipe Sobis, do canal do Curso Enem Gratuito, as dicas para você gabaritar nas questões de Concentração das Soluções Químicas.
A Solubilidade ou Coeficiente de Solubilidade
Coeficiente de solubilidade (Cs) é a máxima quantidade de uma substância (em gramas) que pode ser dissolvida em uma quantidade específica de solvente (geralmente em litros) a uma dada pressão e temperatura. 
|
Coeficiente de solubilidade |
Significado |
|
Cs do NaCl = 357 g/L (0º) |
São necessários 357g de NaCl em 1 litro de água para formar uma solução saturada a 0º |
|
Cs do NaCl = 360 g/L (20º) |
São necessários 360g de NaCl em 1 litro de água para formar uma solução saturada a 20º |
|
Cs do NaCl = 46g/100g (30º) |
São necessários 46g de NaCl em 100g de água para formar uma solução saturada a 30º |
|
Solubilidade (g KNO3 /100g H20) |
Temperatura (ºC) |
|
13 |
0 |
|
18 |
10 |
|
30 |
20 |
|
46 |
30 |
|
64 |
40 |
|
85 |
50 |
|
108 |
60 |
|
136 |
70 |
|
169 |
80 |
|
205 |
90 |
|
246 |
100 |
• A curva de solubilidade é a fronteira entre as regiões I e II e qualquer ponto dessa curva indica que a massa de KNO3 dissolvido é igual ao Cs. Trata-se das soluções saturadas.
Representação: “no estudo das soluções adotaremos o índice 1 para representar o soluto e 2 para representar o solvente. Se não apresentar nenhum índice, está se referindo à solução”
- Exemplo: m = m1 + m2
- Onde, então, m se refere ao conteúdo total da solução, m1 se refere ao soluto, m2 se refere ao solvente envolvido na solução.
Dica 2 – Entenda como identificar o Grau de Pureza dos Reagentes e o Rendimento da Reação nesta aula de Química Enem – https://blogdoenem.com.br/calculo-estequiometrico-quimica-enem/
A Concentração das Soluções:
• Soluções Verdadeiras;
• Misturas homogêneas de um soluto em um solvente.
Titulo (T)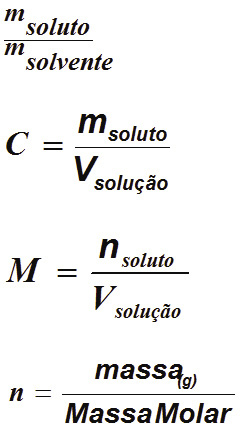
• Não tem Unidade
• Valor sempre menor que 1
• As massas são expressas em gramas
Concentração comum (C)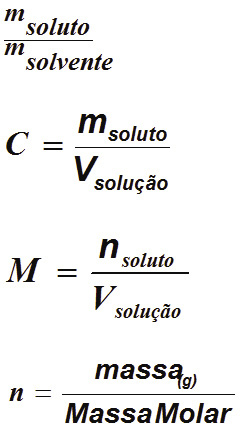
• Massa do soluto em gramas, sobre o volume da solução em litros
Dica 3 – Ácidos, bases, sais e óxidos. Entenda como são constituídas as funções inorgânicas e saiba como não errar as suas nomenclaturas nesta aula de Química Enem – https://blogdoenem.com.br/funcoes-inorganicas-quimica-enem/
Concentração em mols/ litro ( Molaridade – M)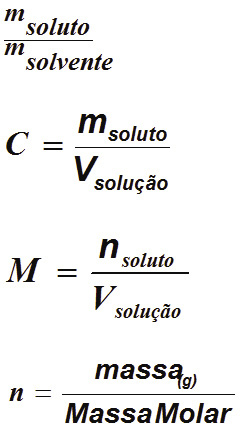
• Número de mols do soluto, sobre o volume da solução em litros.
Obs.
Número de mols;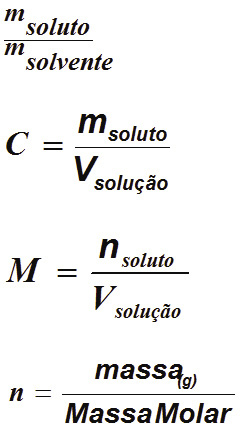
Aula Gratuita sobre Concentração das Soluções
Entenda melhor como calcular a concentração comum com o professor Sobis, do Curso Enem Gratuito! Você já aprendeu com este resumo, então teste seus conhecimentos em seguida com nossos desafios!
Desafios para você resolver e compartilhar:
Questão 01
Uma das maneiras de recuperar um soluto não volátil de uma solução aquosa, consiste no aquecimento da solução com o objetivo de evaporar mais rapidamente a água nela contida. Numa indústria um recipiente contém 500 litros de uma solução aquosa de NaCℓ de concentração 25,0g/L. O volume dessa solução, expresso em litros, que deve sofrer aquecimento para propiciar a obtenção de 500g de NaCℓ(s), é:
a) 50,0
b) 25,0
c) 20,0
d) 200
e) 500
Questão 02
Quatro tubos contêm 20mL (mililitros) de água cada um. Coloca-se nesses tubos dicromato de potássio (K2Cr2O7) nas seguintes quantidades:
|
Massa de K2Cr2O7 (g) |
|
|
tubo A |
1,0 |
|
tubo B |
3,0 |
|
tubo C |
5,0 |
|
tubo D |
7,0 |
A solubilidade do sal, a 20°C, é igual a 12,5g por 100mL de água. Após agitação, em quais dos tubos coexistem, nessa temperatura, solução saturada e fase sólida?
a) Em nenhum.
b) Apenas em D.
c) Apenas em C e D.
d) Apenas em B, C e D.
e) Em todos.
Questão 03
Em uma experiência para determinação da quantidade de álcool na gasolina, foram colocados em uma proveta 25ml de água e 25ml de gasolina sob agitação constante. Sabendo que a medida provisória imposta pelo governo permite um teor igual a 24% de álcool na gasolina, determine o volume da fase aquosa (álcool + água) depois da agitação considerando que essa gasolina está exatamente de acordo com a medida provisória:
a) 50mL
b) 55mL
c) 35mL
d) 31mL
e) 25mL
Questão 04
Uma solução aquosa saturada de acetato de chumbo preparada a 18oC, pesou 75 g e por evaporação forneceu um resíduo sólido de 15g. calcule o Cs do sal a 18oC.
a) 10g de sal/100g H2O
b) 12g de sal/100g H2O
c) 30g de sal/100g H2O
d) 25g de sal/100g H2O
e) 22g de sal/100g H2O
Questão 05
Uma solução aquosa de ácido sulfúrico (H2SO4), para ser utilizada em baterias de chumbo de veículos automotivos, deve apresentar concentração igual a 4mol/L.
O volume total de uma solução adequada para se utilizar nestas baterias, que pode ser obtido a partir de 500mL de solução de H2SO4 de concentração 18mol/L, é igual a:
a) 0,50 L
b) 2,00 L
c) 2,25 L
d) 4,50 L
e) 9,00 L

