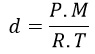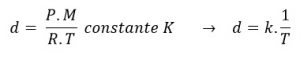Na hora de resolver as questões, considere semque que a densidade é definida como a razão entre a massa (m) e o volume (V) de uma amostra de matéria. Acompanhe agora resumo de química com as professoras Larissa Campos e Munique Dias.
Você sabe por que os balões vendidos preenchidos com hélio (daqueles vendidos em quermesses e parques de diversões) sobem e flutuam no ar e os que a gente enche com o gás expelido pelos pulmões não? E por que os balões com ar quente sobem? Tudo isso tem relação com a densidade dos gases! Vamos relembrar?
Primeiramente, vamos rever rapidamente o conceito de densidade? – A densidade é definida como a razão entre a massa (m) e o volume (V) de uma amostra de matéria.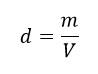 Essa definição geral de densidade é válida para sólidos, líquidos e gases. Você “matou de primeira”, ou ainda está com dúvidas? Vamos esclarecer agora com o resumo da professora Larissa Campos, do canal do Curso Enem Gratuito:
Essa definição geral de densidade é válida para sólidos, líquidos e gases. Você “matou de primeira”, ou ainda está com dúvidas? Vamos esclarecer agora com o resumo da professora Larissa Campos, do canal do Curso Enem Gratuito:
Agora ficou mais fácil pra você compreender. Esta explicaçãoi da professora larissa é bem simples, e “abre a cabeça” para dominar todos os aspectos. Veja agora como calcular a densindade nos gases, na explicação da professora Munique Dias.
Densidade absoluta de um gás
Utilizando a definição de densidade apresentada acima, e conhecendo o volume molar dos gases nas condições em que uma certa substância gasosa se encontra, podemos calcular a densidade de um gás da seguinte forma:
Se estivermos utilizando as CNTP (condições normais de temperatura e pressão), já sabemos que 1 mol ocupa o volume de 22,4 L, e assim basta dividir a massa molar do gás (M) pelo volume molar nas CNTP (22,4 L)
Também existe outro modo de calcular as densidades absolutas dos gases, que é utilizando a Lei do Gás ideal, confira!
P.V = n.R.T (Lei do Gás ideial)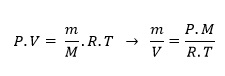
Essa equação é válida somente para o cálculo de densidade dos gases (suposto ideal).
Dica 1 – Reveja também outro assunto muito importante que é Variáveis de estado dos gases. Acesse o nosso blog do Enem e veja um super-resumo preparado pela professora Munique Dias. Vai ficar de fora dessa?
Por que o balão sobe?
Agora já podemos entender porque os balões com ar quente sobem, utilizando a equação apresentada acima.
Quando aumentamos a temperatura no interior do balão, a densidade do ar nele contido diminui, assim, podemos dizer que o balão sobe porque sua densidade é menor que a dor ar exterior. Entenda pela equação:
Para um gás ideal, com a pressão constante, a densidade é inversamente proporcional à temperatura na escala Kelvin.
E, para finalizar: você entende agora porque a fumaça sobe?
A fumaça sobe porque a sua densidade é menor do que a densidade do ar atmosférico, graças a sua alta temperatura.
Agora, para encerrar sua revisão, assista a uma aula do nosso canal Curso Enem Gratuito. Não deixe de estudar!
Exercício sobre os Gases
Teste seus conhecimentos! Resolva esse exercício para treinar o assunto e arrebentar nas provas do Enem e dos vestibulares de todo Brasil!
(Unicamp – SP) Durante os dias quentes de verão, uma brincadeira interessante consiste em pegar um saco plástico, leve, de cor preta, encher ¾ de seu volume com ar, amarrar hermeticamente a sua boca, expondo-o, em seguida, aos raios solares. O ar no interior do saco é aquecido, passando a ocupar todo o volume. Como consequência o saco sobre na atmosfera como um balão. Considerando a pressão atmosférica constante, durante a brincadeira e considerando ainda que inicialmente o ar estava a 27º, calcule a variação da temperatura do bar no interior do saco plástico, entre a situação inicial e a final, quando o gás ocupa todo volume.
Resposta: A variação é de 100oC