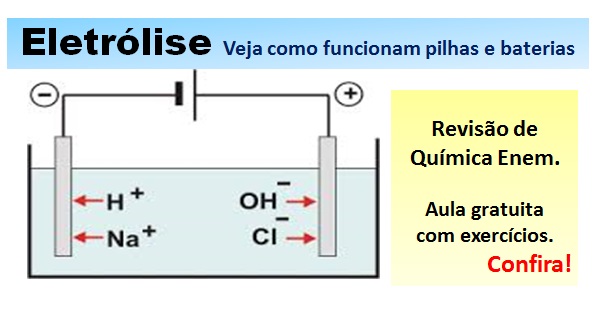
Relembre tudo sobre Eletrólise em solução aquosa nesta aula preparatória para a prova de Química Enem. Estude conosco para o Exame Nacional do Ensino Médio!
Eletrólise em solução aquosa. Revisão Enem e Vestibular.
Eletrólise: “Energia elétrica proveniente de fonte externa, é utilizada para produzir reações de oxidação-redução (redox) não espontâneas.” Se você não ‘entendeu de primeira’, vamos escrever de uma forma diferente: Um processo de Eletrólise (ou Eletroquímica) ocorre quando se aplica (ou se cria) uma corrente elétrica num meio aquoso onde os compostos ali presentes passam por uma reação química que converte energia química em energia elétrica, ou vice-versa.
A presença do circuito elétrico que se fecha ali provoca estas reações. É o fundamento do funcionamento das baterias e pilhas. Uma observação importante é que a fonte de energia externa não pode criar nem destruir elétrons neste processo.
Exemplo:
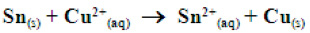
Funcionamento
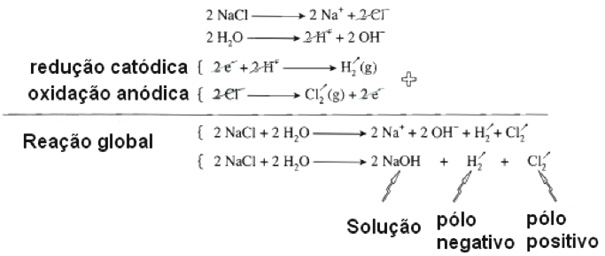
Eletrólise do NaCl em solução aquosa. Ocorre competição entre dissociação da água e do NaCl:
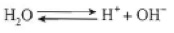
Dissociação da água

Dissociação do NaCl (imagem Wikipedia)
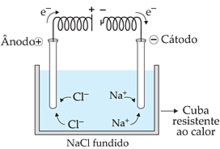
Anodo: No polo negativo, pode ser reduzido o H+ a H2 ou Na+ a Na0
Catodo: No polo negativo, pode ser oxidado o Cl– ou o HO–
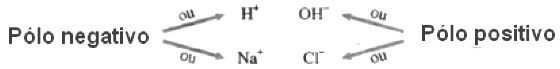
No caso desta representação na imagem ocorrerá primeiramente a descarga (redução) do cátion H+ no polo negativo e descarga (oxidação) do ânion Cl– no polo positivo. Pois estes são mais reativos.
Ordem de redução dos cátions
Au3+ > Pt2+ > Hg2+ > Ag+ > Cu2+ > Ni2+ > Cd2+ > Pb2+ > Fe2+ > Zn2+ > Mn2+ > H3O+ > Al3+ > Mg2+ > Na+ > Ca2+ > Ba2+ > K+ > Li+ > Cs+
Ordem de oxidação dos ânions: Ânions não oxigenados e o HSO4– > HO– > ânions oxigenados e o F–
Análise quantitativa da eletrólise
Leis da eletroquímica
- • Primeira Lei de Faraday
m = k’.Q Q= i.Δt
onde:
m= massa formada ou transformada
k’= constante de proporcionalidade
Q= quantidade de carga elétrica aplicada
i= intensidade da corrente elétrica
Δt= intervalo de tempo
Assim: m= k’.i.Δt . Desta fórmula se depreende que quanto maior a intensidade da corrente elétrica, maior a massa formada.
- • Segunda Lei de Faraday
m= k’’.E
onde:
m= massa formada ou transformada
k’’= constante de proporcionalidade
E= equivalente-grama (é o quociente entre a massa molar pela valência (carga) do átomo).
Para células eletrolíticas ligadas ou conectadas em série:
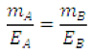
Equação geral da eletroquímica
Onde constante de Faraday (F) = 96500 C/mol
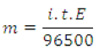
I em ampères e t em segundos
Saiba mais!
Com o Curso Enem Gratuito, disponível no Youtube, você revisa e aprofunda seus conhecimentos sobre eletrólise em solução aquosa. Após assistir, revise o que você aprendeu respondendo aos nossos desafios!
Desafios para você resolver e compartilhar
Questão 1
A eletrólise é muito empregada na indústria com o objetivo de reaproveitar parte dos metais sucateados. O cobre, por exemplo, é um dos metais com maior rendimento no processo de eletrólise, com uma recuperação de aproximadamente 99,9%. Por ser um metal de alto valor comercial e de múltiplas aplicações, sua recuperação torna-se viável economicamente.
Suponha que, em um processo de recuperação de cobre puro, tenha-se eletrolisado uma solução de sulfato de cobre (II) (CuSO4) durante 3h, empregando-se uma corrente elétrica de intensidade igual a 10A. A massa de cobre puro recuperada é de aproximadamente.
Dados: Constante de Faraday F= 96500 C/mol; Massa molar em g/mol: Cu= 63,5.
a) 0,02g
b) 0,04g
c) 2,40g
d) 35,5g
e) 71,0g
Dica 1 – Preparado para o Exame Nacional do Ensino Médio? Que tal revisar sobre a Eletrólise em mais esta aula de Química Enem e garantir uma boa nota nas provas – https://blogdoenem.com.br/eletrolise-quimica-enem-2/
Questão 2
O alumínio é o segundo metal mais utilizado no mundo. Sua resistência à corrosão é devida à camada aderente e impermeável de óxido que se forma sobre a superfície do metal. Essa camada protetora pode ser tornada mais espessa através de um processo denominado anodização (figura abaixo). Nesse processo, o oxigênio é gerado por eletrólise, segundo a semirreação.
H2O(l) → 1/2O2(g) + 2e– + 2H+(aq)
O oxigênio reage, em seguida, com o alumínio, formando o óxido correspondente.
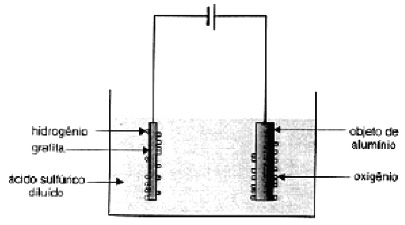
Com referência ao exposto, a afirmativa falsa é:
a) a anodização aumenta a resistência do alumínio à corrosão.
b) o fluxo de elétrons, pelo circuito externo, ocorre na direção do abjeto de alumínio.
c) o objeto de alumínio constitui o ânodo da célula eletroquímica.
d) o processo de anodização consome energia elétrica.
e) o processo de anodização é um tipo de eletrólise em solução.
Dica 2 – Relembre sobre os principais tipos de Pilhas nesta aula de Química Enem sobre Células Secundárias, Células Primárias e Células Combustível. Estude conosco! – https://blogdoenem.com.br/pilhas-principais-tipos-quimica-enem/
Questão 3
Da água do mar, podem ser obtidas grandes quantidades de um sal que é a origem das seguintes transformações:
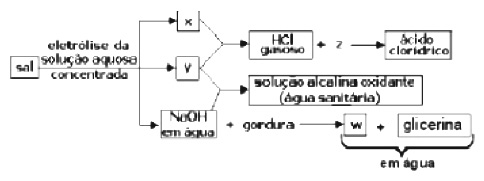
Neste esquema, X, Y, Z e W representam:
a) x= oxigênio; y= cloro; z= hidrogênio; w= sabão
b) x= sódio; y= oxigênio; z= dióxido de carbono; w= triglicerídeo
c) x= hidrogênio; y= cloro; z= água; w= sabão
d) x= cloro; y= hidrogênio; z= água; w= carboidratos
e) x= hidrogênio; y= cloro; z= dióxido de carbono; w= triglicerídeo
Dica 3 – Estude tudo sobre Pilhas: Células Galvânicas em mais esta aula de revisão para a prova de Química Enem. O Exame Nacional do Ensino Médio está chegando! – https://blogdoenem.com.br/pilhas-quimica-enem/
Questão 4
O alumínio é um metal leve e muito resistente, tendo diversas aplicações industriais. Esse metal passou a ser explorado economicamente a partir de 1886, com a implementação do processo Héroult-Hall. O alumínio é encontrado geralmente na bauxita, minério que apresenta alto teor de alumina (Al2O3 ). O processo Héroult-Hall consiste na redução do alumínio presente na alumina para alumínio metálico, por meio de eletrólise. A semirreação de redução é representada por:
Al3+ + 3e– → Al0
Se uma cela eletrolítica opera durante uma hora, passando carga equivalente a 3600F, a massa de alumínio metálico produzida é.
a) 32,4 kg
b) 96,5 kg
c) 97,2 kg
d) 3,60 kg
e) 27,0 kg
Questão 5
Dados:
2H+ + 2e– → H2(aq) E=0,0 V
Na+ + e– → Na E=-2,7 V
A produção industrial de gás cloro (CL2) ocorre a partir da eletrólise de uma solução aquosa de cloreto de sódio. Sobre esse processo foram feitas algumas afirmações:
I. O ânion cloreto é oxidado no ânodo (polo positivo) da cuba eletrolítica.
II. No cátodo, o cátion sódio é reduzido, produzindo sódio metálico.
III. Nesse processo, também são produzidos gás hidrogênio (H2 ) e solução aquosa de soda cáustica (NaOH).
As afirmações corretas são:
a) apenas I.
b) apenas I e III.
c) apenas II e III.
d) apenas I e II.
e) todas.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!