É hora de revisar Eletrólise em mais esta aula de Química para se garantir nas questões de Química no Vestibular e no Enem. É conteúdo clássico que sempre cai. Confira nesta aula online com dicas e lista de exercícios.
O que é a eletrólise? Você lembra, ‘na ponta da língua’? Se vacilou um segundo para responder, é porque está na hora de revisar! Vem com a gente recuperar os fundamentos da Elrtroquímica, e ver o que é e como funciona uma reação eletrolítica do tipo Aquosa, ou do tipo Ígnea:
Vamos começar pelo começo: Eletrólise nada mais é do que “A Energia elétrica proveniente de fonte externa, é utilizada para produzir reações de oxidação-redução (redox) não espontâneas.”
Então, esta definição ‘matou de primeira’ as suas dúvidas, ou ainda está complicado? Acrescente mais esta informação à definição, para ela ficar completa: A fonte de energia externa não pode criar nem destruir elétrons.
Introdução à Eletroquímica
Confira com o professor Felipe Sobis, do canal do Curso Enem Gratuito, as dicas básicas com os fundamentos para você resolver as questões e gabaritar Eletrólise nas provas do Enem, dos vestibulares, ou do Encceja:
Veja na equação uma representação reação química clássica de ‘Eletrólise’> Exemplo: 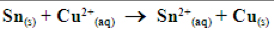
Veja o que é uma Eletrólise Ígnea
A Eletrólise Ígnea ocorre com a Transformação Química que ocorre na ausência de água. É feita com substâncias iônicas em fase líquida (fundidas).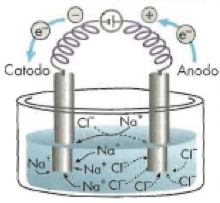
Eletrólise do NaCl fundido:
- No polo negativo (cátodo): Na+ + e– → Na
- No polo positivo (ânodo): Cl– – e– → ½ Cl2
- Note que o ânion Cl– vai para o ânodo, onde sofre oxidação e o cátion Na+ vai para o cátodo, onde sofre redução.

O que é a Eletrólise
Veja agora com a professora Larissa Campos, do canal do Curso Enem Gratuito, o resumo básico, com a essência que você precisa para mandar bem na resolução de problemas de Eletroquímica no Enem.
A eletrólise é um processo eletroquímico forçado, não espontâneo, que visa obter compostos importantes que não existem na natureza. Neste processo de eletrólise, é necessário fornecer eletricidade para que as reações de oxirredução possam ocorrer, pois elas não ocorrem naturalmente.
A eletrólise ocorre em substâncias iônicas, que se mantêm por meio de ligações iônicas realizadas entre metais com ametais. Nesta aula, a professora Larissa te ensina os conceitos gerais do que é e como funciona a eletrólise.
Resumo-Esquema sobre Eletrólise:
|
Cátodo |
Ânodo |
|
|
Nas pilhas |
É o polo [+] (aqui ocorrem reduções) |
É o polo [-] (aqui ocorrem oxidações) |
|
Na eletrólise |
É o polo [-] (aqui ocorrem reduções |
É o polo [+] (aqui ocorrem oxidações) |
Veja os 10 Conteúdos que mais caem de Química no Enem

Confira a lista com as questões de Química que são mais frequentes nas provas do Exame Nacional do Ensino Médio (Enem) e também nos vestibulares. Além da relação do que mais cai você tem aulas gratuitas para cada dos temas ‘top 10’. Acesse as 10 questões de Química que mais caem no Enem.
Desafios para você estudar Eletrólise
Questão 1
(ENEM)
Para que apresente condutividade elétrica adequada a muitas aplicações, o cobre bruto obtido por métodos térmicos é purificado eletroliticamente. Nesse processo, o cobre bruto impuro constitui o ânodo da célula, que está imerso em uma solução de CuSO4. À medida que o cobre impuro é oxidado no ânodo, íons Cu2+ da solução são depositados na forma pura no cátodo.
Quanto às impurezas metálicas, algumas são oxidadas, passando à solução, enquanto outras simplesmente se desprendem do ânodo e se sedimentam abaixo dele. As impurezas sedimentadas são posteriormente processadas, e sua comercialização gera receita que ajuda a cobrir os custos do processo. A série eletroquímica a seguir lista o cobre e alguns metais presentes como impurezas no cobre bruto de acordo com suas forças redutoras relativas.
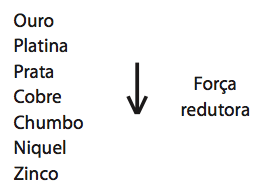
Entre as impurezas metálicas que constam na série apresentada, as que se sedimentam abaixo do ânodo de cobre são:
a) Au, Pt, Ag, Zn, Ni e Pb.
b) Au, Pt e Ag.
c) Zn, Ni e Pb.
d) Au e Zn.
e) Ag e Pb.
Dica 1 – Relembre sobre os principais tipos de Pilhas nesta aula de Química Enem sobre Células Secundárias, Células Primárias e Células Combustível. Estude conosco!
Questão 2
O alumínio amplamente utilizado pelo mundo, é obtido por eletrólise, através de um processo cuja reação pode ser representada pela equação:
Al2O3 + C → Al + CO2
Os coeficientes que balanceiam corretamente a equação são:
a) 1-2-2-4.
b) 2-1-4-1.
c) 1-3-2-3.
d) 2-3-4-3.
e) 3-1-2-4.
Dica 2 – Estude tudo sobre Pilhas: Células Galvânicas em mais esta aula de revisão para a prova de Química Enem. O Exame Nacional do Ensino Médio está chegando!
Questão 3
Um método industrial utilizado para preparar sódio metálico é a eletrólise de cloreto de sódio puro fundido. Com relação à preparação de sódio metálico, é incorreto afirmar que:
a) Esse processo trata-se de uma eletrólise ígnea.
b) a formação de sódio metálico ocorre no eletrodo negativo.
c) a eletrólise é uma reação espontânea.
d) a quantidade, em mol, de cloro (Cl2 ) formada é menor que a de sódio metálico.
e) a quantidade de sódio metálico obtido é proporcional à intensidade da corrente aplicada.
Dica 3 – Relembre tudo sobre Equilíbrio Iônico em mais esta aula preparatória para a prova de Química Enem. Estude com a gente para o Exame Nacional do Ensino Médio!
Questão 4
A figura a seguir representa uma célula eletrolítica durante a eletrólise de uma substância pura, o cloreto de sódio fundido (NaCl).
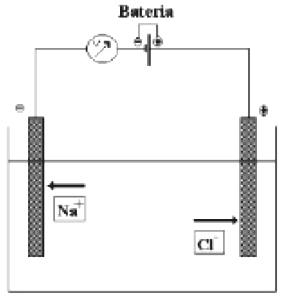
É incorreto afirmar que durante o funcionamento dessa célula:
a) a bateria está sendo carregada.
b) a bateria está sendo descarregada.
c) no cátodo ocorre a reação: 2Na+ + 2e– → 2Na0.
d) no ânodo ocorre a reação: 2Cl– → Cl2 + 2e–.
e) a reação global da célula é: 2Na+ + 2Cl–→ 2Na0 +Cl2.
Questão 5
Quanto à eletrólise ígnea e em solução do NaCl, é correto afirmarmos:
a) Em ambas as eletrólises obtêm-se como produto o sódio metálico.
b) A eletrólise em solução é mais segura e resulta em melhores rendimentos.
c) Apenas através da eletrólise ígnea é possível obter-se o sódio metálico.
d) A eletrólise ígnea resulta na produção de NaOH como produto principal.
e) Durante esses processos, é gerado energia elétrica espontaneamente.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!



