Na aula de Química de hoje para o Enem 2013, vamos estudar sobre Gases – conteúdo muito importante para o Enem e também vestibulares de várias universidades brasileiras. Fique ligado e atento a essa dica!
Para a aula de hoje, indicamos duas vídeo-aulas do professor Daniel Buckentin, que explica sobre as Leis dos Gases e também uma terceira aula que fala sobre a Lei dos Gases Ideais ( PV = nRT ), do canal Khan Academy Português .
Para aqueles que ainda não abriram os livros de Química para estudar para o Enem 2013, é importante ter em mente alguns conceitos básicos como massa molar, volume molar e número de Avogrado. Portanto, uma lembrada rápida sobre esses conceitos irá ajudar bastante.
Massa molar para o Enem 2013 – é a massa em gramas de um mol de entidades elementares – átomos, moléculas, íons, elétrons, outras partículas ou outros grupos específicos de tais partículas. É representada pela letra “M” e expressa na unidade g/mol. A massa molar de um elemento químico ou de uma substância é numericamente igual à massa atômica desse elemento ou do total das massas atômicas componentes da substância em unidades de massa atômica. Desta forma, conhecendo-se a massa atômica de um elemento (expressa em unidades de massa atômica, u.m.a.) ou dos elementos constituintes da substância, sabe-se também a sua massa molar – expressa em g/mol. Ex.: a massa atômica total da substância água, H2O = 18 u.m.a., logo M = 18 g/mol – massa de 6,02 x 1023 moléculas de água, do total de seus átomos.
Volume molar para o Enem 2013 – é a razão entre o volume e a quantidade de matéria. Equivale ao volume ocupado por 1 mol de entidades elementares (átomos, moléculas, íons, grupos específicos, partículas, etc). A unidade de medida correspondente no SI é o metro cúbico por mol (m3/mol) porém as medidas mais usuais são o centímetro cúbico por mol (cm3/mol), o mililitro por mol (mL/mol) e o litro por mol (L/mol).
Número de Avogrado para o Enem 2013 – antigamente conhecida como número de Avogadro (em homenagem a Amedeo Avogadro), é uma constante física fundamental que representa um mol de entidades elementares (entidades elementares significando átomos, moléculas, íons, elétrons, outras partículas, ou grupos específicos de tais partículas). Formalmente, a constante de Avogadro é definida como o número de átomos de carbono-12 em 12 gramas (0,012 kg) de carbono-12, o que é aproximadamente igual a 6,02 × 1023 ou 602 sextilhões. Historicamente, o carbono-12 foi escolhido como substância de referência porque sua massa atômica podia ser medida de maneira bastante precisa. Conhecendo-se a constante de Avogadro e a massa atômica de um elemento, é possível calcular a massa em gramas de um único átomo.
Vamos calcular para o Enem 2013, por exemplo, a massa de um átomo de alumínio (Al) em gramas. Consideraremos que o número de Avogadro é  = 6 × 1023.
= 6 × 1023.
- Primeiro temos que descobrir a massa molar do átomo de alumínio, que é numericamente igual à massa atômica do alumínio (27 u). Ou seja,
 .
.
- Sabendo isso, temos que 27 g de alumínio (Al) correspondem a 1 mol de átomos ou 6 × 1023 átomos. Resta descobrir a massa m que corresponde a 1 átomo de alumínio .
- Tendo isso em vista, concluímos, fazendo uma proporção simples, que
 ou
ou  . Esse resultado é a massa do átomo de alumínio em gramas.
. Esse resultado é a massa do átomo de alumínio em gramas.
Fique atento às aulas abaixo. Ela são uma sequência de duas aulas sobre os Gases e podem te ajudar para o Enem 2013.
A Lei dos Gases possui inúmeras aplicações práticas e é útil para o entendimento de vários fenômenos da Natureza! Para o Enem 2013, sugiro que, além de saber fazer exercícios matemáticos, é fundamental entender a lógica dessa simples Equação: PV = nRT. Para isso, então, fique atento à aula do Khan Academy Português abaixo sobre os Gases. Vamos lá!
Depois de assistir essas aulas, você entenderá por que P (pressão) e V (volume) são inversamente proporcionais e que V ( volume) e T (temperatura) são diretamente proporcionais. É muito importante entender essa lógica dos Gases para o Enem 2013, pois na sua prova boa parte da avaliação vem da interpretação dos conteúdos aprendidos. Fique atento e não perca nenhum detalhe!
E que tal fazer uns exercícios agora, depois dessa aula bacana, para treinar para sua prova do Enem 2013, do fim do ano? Vamos lá? Bons estudos!
EXERCÍCIOS
1- (Unip-SP) Uma dada massa de um gás perfeito está a uma temperatura de 300 K, ocupando um volume V e exercendo uma pressão p. Se o gás for aquecido e passar a ocupar um volume 2V e exercer uma pressão 1,5p, sua nova temperatura será:
a) 100 K
b) 300 K
c) 450 K
d) 600 K
e) 900 K
2- (PUCCamp-SP) Um gás perfeito é mantido em um cilindro fechado por um pistão. Em um estado A, as suas variáveis são: pA = 2,0 atm; VA = 0,90 litros; TA = 27ºC. Em outro estado B, a temperatura é TB = 127ºC e a pressão é pB = 1,5 atm. Nessas condições, o volume VB, em litros, deve ser:
a) 0,90
b) 1,2
c) 1,6
d) 2,0
e) 2,4
GABARITO
1-E ; 2-C.
Confira o Simulado – Clique AQUI.
Confira Como se preparar para o Enem 2013 – Clique AQUI.
Agora que você já sabe tudo sobre o Enem, que tal conhecer nossa rede de blogs?
Gostou do post? Use os botões abaixo e ao lado para espalhar por suas redes sociais (sabemos que o Facebook está aberto ai no cantinho do seu computador). E, claro, também usar os espaços para comentários abaixo, deixando sua critica, sugestão e também xingamentos.
Nossas redes sociais:
Facebook: /RedeEnem (Clique AQUI para saber como receber TUDO sobre o Enem 2013)
Twitter: @RedeEnem
Canal no Youtube: Rede Enem
Google+ : Rede Enem
Fonte: Khan Academy. Wikipédia. Vestibular 1.
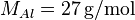 .
.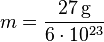 ou
ou  . Esse resultado é a massa do átomo de alumínio em gramas.
. Esse resultado é a massa do átomo de alumínio em gramas.