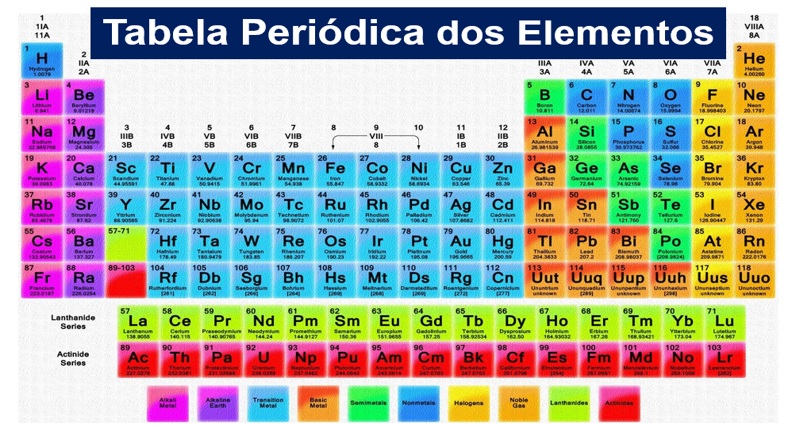
Confira as principais características da Tabela Periódica. Aprenda os fundamentos para a Classificação dos Elementos Químicos a partir de suas Características e Propriedades. Vale para o Enem, o Encceja, e os Vestibulares. Vem!
Você já está se preparando para o Enem, certo? Mas, e a Tabela Periódica de Mendeleev, você domina? Ela é ‘sua amiga’ ou desperta o terror? Muita gente perde pontos só porque ‘pensa’ que não entende a Classificação dos Elementos Químicos. Vem com o Blog do Enem para superar esse medo todo e mandar bem.
Como critérios para a classificação dos elementos químicos dentro da Tabela Periódica de Mendeleev, utilizam-se as semelhanças entre as suas propriedades físicas e químicas, que estão associadas ao número de elétrons na camada de valência.
A Tabela Periódica
Esta é a formulação que gera os padrões da Tabela Periódica. Achou complicado? Vamos traduzir para você mandar bem no Enem e no Vestibular.
Desde o início do século XIX, várias tentativas, sem grande sucesso, foram feitas para organizar os elementos. O trabalho mais detalhado foi feito em 1869, na cidade de São Petersburgo, pelo químico russo Dmitri Mendeleev (1934 – 1907).
A origem da Tabela Periódica – Este químico classificou os elementos químicos em ordem crescente de massa atômica, respeitando as propriedades químicas.
Veja na imagem a atual da Tabela Periódica de Mendeleev: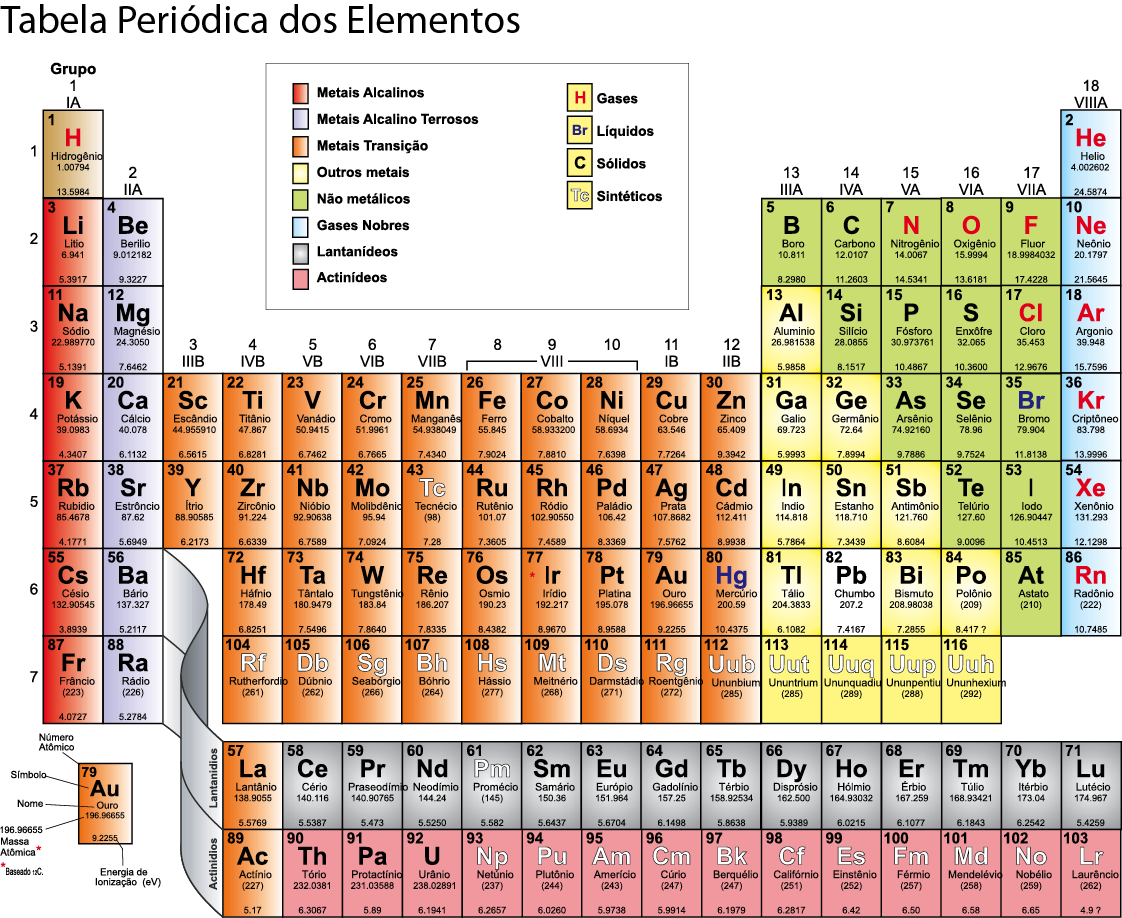 Com o conhecimento da estrutura atômica, ficou demonstrado que a identidade de um elemento químico está relacionada com o seu número de prótons. Isso implicou numa reformulação da Tabela Periódica.
Com o conhecimento da estrutura atômica, ficou demonstrado que a identidade de um elemento químico está relacionada com o seu número de prótons. Isso implicou numa reformulação da Tabela Periódica.
A origem da Tabela Periódica
Dentre os 109 elementos conhecidos, temos os naturais, que constituem a matéria do nosso mundo físico, e os artificiais, que foram obtidos em laboratórios de pesquisa nuclear. Existem cerca de 1730 elementos atualmente. Esse número compreende os isótopos de todos os átomos.
Os Períodos
Denomina-se período cada uma das linhas da tabela. O número do período corresponde ao número de camadas ocupadas pelos elétrons. No Primeiro Período, elétrons até à 1ª camada. No Segundo Período, elétros até à 2ª Camada, e assim por diante. Daí termos sete períodos.
Veja na imagem todos os Períodos da Tabela Periódica de Mendeleev, com os respectivos níveis de Energia do Átomo: 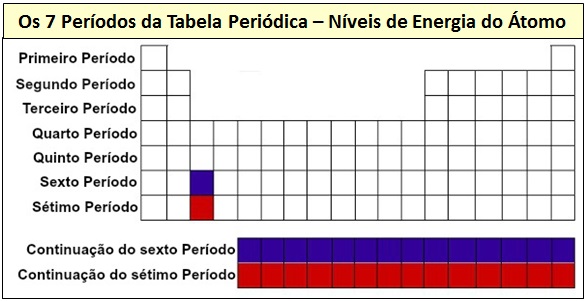 Observe na imagem acima como você pode ‘ler e interpretar’ a Tabela Periódica.
Observe na imagem acima como você pode ‘ler e interpretar’ a Tabela Periódica.
As dicas da Tabela Periódica
Veja com o professor Sobis, do Canal Curso Enem Gratuito, um resumo simples e rápido para você dominar os fundamentos da Tabela Periódica de Mendeleev:
Muito bom este resumo do professor Sobis com as dicas para você aprender a utilizar as informações da tabela periódica de Mendeleev. Agora, vamos continuar para ver as famílias que agrupam os elementos químicos:
As Famílias da Tabela Periódica
As dezoito colunas da tabela são denominadas famílias ou grupos. Os elementos que pertencem a uma mesma família apresentam propriedades químicas semelhantes, pois possuem a mesma quantidade de elétrons na ultima camada.
Modernamente, as famílias são numeradas de 1 a 18, eliminando-se o uso das letras. Observamos na tabela que as famílias são designadas pelas letras A e B.
As Famílias indicadas pela letra A e a família zero recebem denominações especificas. Veja:
• Família 1 (1A): metais alcalinos
• Família 2 (2A): metais alcalinos terrosos
• Família 13 (3A): família do Boro
• Família 14 (4A): família do carbono
• Família 15 (5A): família do nitrogênio
• Família 16 (6A): calcogênios
• Família 17 (7A): halogênios
• Família 18 (0): gases nobres
Os Fundamentos da Tabela Periódica:
- Os elementos químicos estão ordenados da esquerda para a direita, em ordem crescente de numero atômico (ex: H (z=1), He (z=2), Li (z=3), Be (z=4) …)
- A linha vertical ou coluna na tabela periódica corresponde a uma família ou grupo de elementos químicos que apresentam uma regularidade na variação de propriedades químicas e físicas e mesmo número de elétrons na sua camada de valência. Por exemplo: Os elementos da família 1, 2 e de 13 a 18, que eram antigamente representados pelos grupos 1A, 2A, 3A, 4A, 5A, 6A, 7A, e 8A apresentam 1, 2, 3, 4, 5, 6,7 e 8 elétrons na sua camada de Valência, respectivamente.
- Existem dois tipos diferentes de grupos, o dos elementos representativos (representados pelos grupos 1A a 8A) e o dos elementos de transição (localizados na região central da tabela periódica). Os lantanídeos e os actinídeos são conhecidos como elementos de transição interna.
- O desenho abaixo apresenta a tabela periódica. Agora, leia novamente os fundamentos e vá relacionando a leitura com a imagem da Tabela.
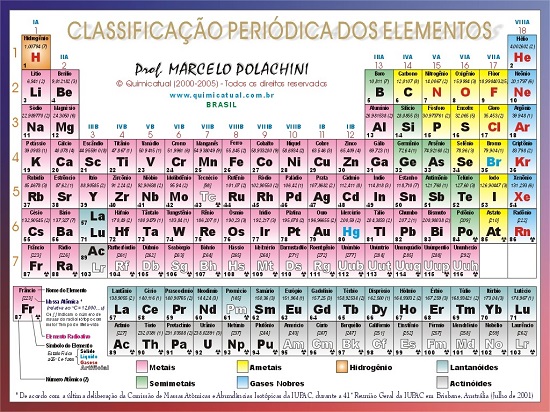
Gostou da explicação sobre as características da tabela periódica?
Assista agora outro vídeo do Youtube do Curso Enem Gratuito em que explicamos mais sobre a tabela periódica e a localização dos seus elementos. Não deixe de conferir!
Hidrogênio – O elemento químico mais abundante
O hidrogênio é diferente de todos os outros elementos e deveria ser colocado isoladamente na tabela periódica, portanto deveria ser colocado isoladamente na tabela; contudo, ele aparece na família 1A por apresentar um elétron no subnível s na sua única camada.
Na imagem a seguir veja aula gratuita sobre os três isótopos do Hidrogênio: Prótio, Deutério, e Trítio. Confira aula gratuita sobre os Isótopos do Hidrogênio
Confira aula gratuita sobre os Isótopos do Hidrogênio
Em certas tabelas o elemento hidrogênio está colocado na família 7A pois ele é um não-metal. A família 8B corresponde a três colunas: famílias 8, 9, 10.
Depois temos a 3 (3B), 4 (4B), 5 (5B), 6 (6B), 7 (7B), 11 (11B) e 12 (12B). Veja uma aula completa sobre os Isótopos do Hidrogênio, e as características do Elemento que está na água e que pode ser o combustível ecológico do futuro.
Dica do Blog – Para gabaritar em Química no próximo Enem, relembre nesta aula os modelos atômicos e as partículas fundamentais, como o Átomo. Revisão desde o modelo de Demócrito e Leucipo, John Dalton, Thomson, Rutherford, e Niels Bohr:
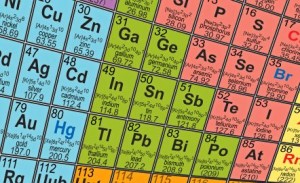
Subdivisão da Tabela Periódica
Uma outra classificação que pode ser atribuída aos elementos químicos é quanto as suas propriedades.
• Metais: Apresentam brilho, são bons condutores de calor e eletricidade, são maleáveis, apresentam dureza e tenacidade, possuem densidade e pontos de fusão e ebulição altos.
• Semimetais: São elementos que apresentam propriedades intermediárias entre os metais e os não-metais (possuem pouca tendência a perder elétrons e formar cristais como os metais, não são bons condutores de eletricidade e calor).
• Não-metais: Não apresentam brilho, dão origem a substâncias moleculares, não apresentam maleabilidade e possuem na sua maioria pontos de fusão e ebulição baixos.
Configuração eletrônica da Tabela Periódica
• Se o subnível mais energético é o s ou o p da ultima camada, dizemos que o elemento é representativo; famílias do grupo A. Neste grupo podemos localizar os elementos na tabela partindo do número de elétrons que o elemento possui na última camada.
Ex: 11Na = 1s2 2s2 2p6 3s1 → 3 elétrons na última camada = família 3A
• Se o subnível mais energético é o d da penúltima camada, dizemos que o elemento é de transição externa. Entretanto, se o subnível mais energético é o f da antepenúltima camada, dizemos que o elemento é de transição interna.
Como conseqüência da distribuição dos elementos na tabela periódica segundo o número atômico, as propriedades químicas e a configuração eletrônica, podemos caracterizá-los sob um novo aspecto.
Localização de um elemento na tabela periódica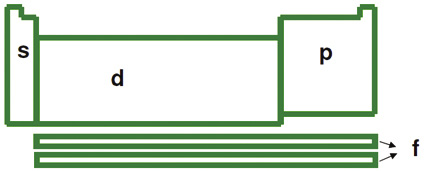 Conhecendo um pouco sobre distribuição eletrônica e organização da tabela periódica, é possível você localizar a maioria dos elementos químicos.
Conhecendo um pouco sobre distribuição eletrônica e organização da tabela periódica, é possível você localizar a maioria dos elementos químicos.
Exemplo: Um elemento X com número atômico 12: 1s2 2s2 2p6 3s2
• a sua última camada de energia é a 3ª, então esse elemento está no 3º período.
• possui 2 elétrons na última camada, então está na família 2A.
• nos elementos de transição, o número de elétrons deverá ser visto nos subníveis d caso seja transição externa e f transição interna.
Aula Gratuita sobre Tabela Periódica
Antes de fazer os exercícios abaixo complete a sua revisão sobre as Propriedades dos Elementos Químicos e a organização da Tabela Periódica com este vídeo do professor Salman Khan. É uma excelente síntese. É conferir e nunca mais esquecer:
Nada de deixar a Tabela Periódica para a última hora dos estudos. O conteúdo cai bastante em questões do Enem e nos vestibulares também.
Então, reserve uma parte do seu tempo para os estudos de Química e para as características da Tabela Periódica de Mendelev. Cai direto.
Se você não dominar os fundamentos para a classificação dos Elementos Químicos, fica difícil fazer pontos para disputar os cursos com as maiores notas de corte no Sisu, no Prouni ou no Fies.
Dicas do Blog do Enem
Dica 2: Confira todas as notas de corte do Sisu: https://blogdoenem.com.br/notas-corte-universidades/
Dica 3: As melhores apostilas para você se dar bem no Enem: https://blogdoenem.com.br/apostilas-gratis/
Exercícios sobre Tabela Periódica:
Com a Tabela Periódica em mãos ou na tela do Blog do Enem, faça estes exercícios para treinar antes do Enem
Você consegue responder corretamente? – Então, compartilhe a sua resposta nos comentários ao final do post ou no Facebook.
Questão 2: Com relação à tabela periódica:
I.Os elementos mais eletronegativos estão à esquerda da tabela.
II.Em um período, em geral, o tamanho do átomo aumenta da direita para a esquerda.
III.Em um período, em geral, quanto mais prótons tem um átomo, maior ele é.
IV.Os metais ficam à esquerda e os não-metais à direita da tabela.
V.Metais ganham elétrons mais facilmente que os não-metais
a)I e III
b)II e IV
c)III e V
d)I e II
e)IV e V
Compartilhe a sua resposta nos comentários ou no Facebook da Rede Enem.
Questão 3: Assinale o elemento químico classificado como alcalino-terroso.
a)K
b)Ca
c)Ti
d)Ga
e)Ar
Já acabou? Então confira o gabarito logo a seguir, e compartilhe o raciocínio que você desenvolveu!
Resposta 1: D
Resposta 2: B
Resposta 3: B
Gostou do vídeos?! Pesquise mais, procure exercícios e treine bastante para o Enem.
Vem com a gente!
Fonte: Canal Video Aulas, Scrib