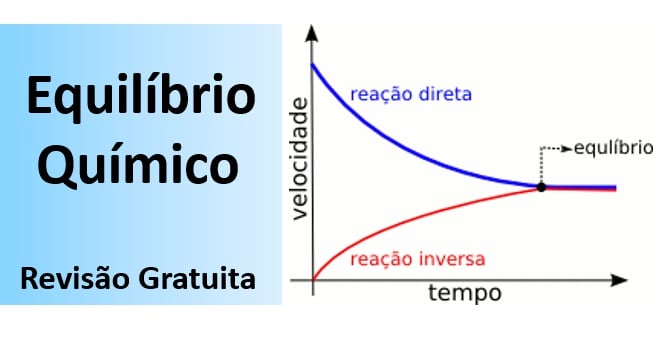
O equilíbrio químico é dinâmico. e constitui uma reação reversível onde a velocidade da reação direta é igual à da reação inversa (a composição da mistura reacional é constante). Tire todas as suas dúvidas e fique preparado para a prova de Química Enem nesta aula sobre o Equilíbrio Químico.
Equilíbrio Químico – Você lembra do essencial para conseguir resolver as questões do vestibular e do Enem? Se não estiver com tudo ‘na ponta da lingua’, é hora de revisar com as dicas e uma série de exercícios resolvidos.
Começando pelo começo. A regra geral é que “Todas as reações químicas atingem o equilíbrio.” No dia a dia da ciência química você precisa de alguns fundamentos para chegar à compreensão exata. Vamos seguir: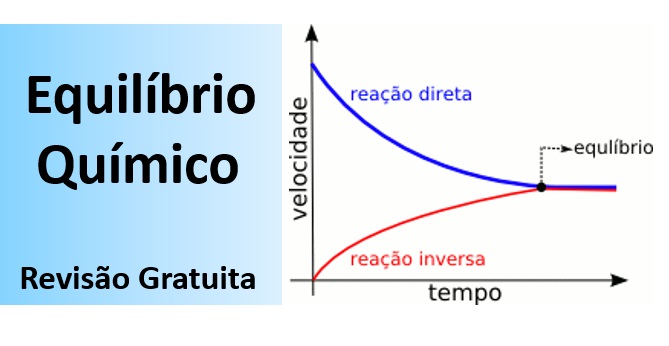
- O equilíbrio químico é dinâmico (as reações direta e reversa continuam ocorrendo), ou seja, constitui uma reação reversível;
- No equilíbrio, a velocidade da reação direta é igual à da reação inversa (a composição da mistura reacional é constante).
- Quer entender melhor o equilíbrio químico? Veja a aula do Curso Enem Gratuito que o prof. Felipe Sobis, que vai te ajudar geral:https://youtu.be/qOiEiYOl3aM
Veja este exemplo para compreender o Equilíbrio Químico desta equação química:
3H2(g) + N2(g) 2NH3(g) Veja nos gráficos a Reação Direta e a Reação Inversa, e compreenda o ‘Equilíbrio’
2NH3(g) Veja nos gráficos a Reação Direta e a Reação Inversa, e compreenda o ‘Equilíbrio’
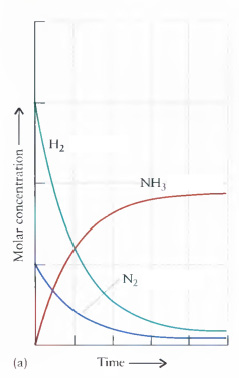
(a) Reação direta
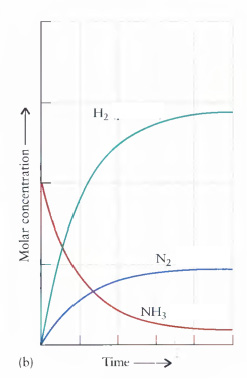
(b) Reação inversa: Quando uma reação atinge o equilíbrio, as concentrações dos reagentes e produtos permanecem constantes.
Revise os principais tópicos sobre Equilíbrio Químico
Grau de equilíbrio de um reagente (α)
É o quociente entre a quantidade de mols de um reagente que realmente reage até atingir o equilíbrio da reação e a quantidade inicial de mols adicionados desse reagente.

Constante de equilíbrio
“No equilíbrio, a composição da mistura reacional pode ser expressa em termos de uma constante de equilíbrio (K).” Ela só é alterada pela variação de temperatura, logo, para medi-la é necessário que a temperatura seja constante.
Para a reação geral:
aA + bB D cC + dD
Dica 1 – Estude sobre os fatores que influenciam uma reação química e a Natureza dos Reagentes em mais uma aula preparatória para a prova de Química Enem – https://blogdoenem.com.br/natureza-dos-reagentes-quimica-enem/
Constante de equilíbrio para solutos
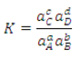
Onde a é a atividade de cada componente e depende da concentração e da carga do soluto. Para soluções diluídas, a atividade é igual à concentração molar da solução ou à pressão parcial dos gases.
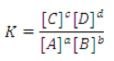
Onde [ ] representa concentração molar (mol/L)
Constante de equilíbrio para gases

Onde P representa a pressão parcial de cada componente em bar (1bar  1atm).
1atm).
Líquidos e sólidos puros possuem atividade igual a 1.
Ex.:
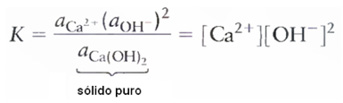
OBS.:
Q = coeficiente da reação: mostra a composição da reação a qualquer instante da reação
K = constante de equilíbrio da reação: mostra a composição da reação no equilíbrio
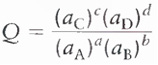
Dica 2 – Que tal revisar tudo sobre Cinética Química e garantir a sua nota na prova de Química Enem? Estude com a gente para o Exame Nacional do Ensino Médio! – https://blogdoenem.com.br/cinetica-quimica-enem/
Deslocamento do equilíbrio
Princípio de Le Chatelier:
“Quando uma perturbação é aplicada a um sistema em equilíbrio dinâmico, o equilíbrio tende a se ajustar de forma a minimizar o efeito da perturbação.”
Adição de reagentes:
- Le Chatelier: A adição de um reagente tende a ser minimizada pelo seu consumo e formação de mais produtos (o equilíbrio é deslocado no sentido de formação dos produtos).
- Termodinâmica: Logo após a adição de mais reagente, Q < K, logo a reação tende a formar mais produtos até Q atingir K.
Adição de produtos:
- Le Chatelier: A adição de um produto tende a ser minimizada pelo seu consumo e formação de mais reagentes (o equilíbrio é deslocado no sentido de formação dos reagentes).
- Termodinâmica: Logo após a adição de mais produto, Q > K, logo a reação tende a formar mais reagentes até Q atingir K.
Variação na pressão
Desloca o equilíbrio de reações que envolvam gases.
Um aumento na pressão de uma reação em equilíbrio desloca o equilíbrio no sentido de formação de menos moles de moléculas gasosas.
Ex.:

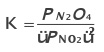
Como PV= nRT
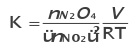

Variação na temperatura
Um aumento na temperatura de uma reação em equilíbrio desloca o equilíbrio no sentido da reação endotérmica.
Obs.: O aumento da temperatura altera a constante de equilíbrio.
Reação direta endotérmica:
CALOR + aA + bB  cC + dD
cC + dD
∆H > 0
Reação direta exotérmica:
aA + bB  cC + dD + CALOR
cC + dD + CALOR
∆H < 0
Exercícios resolvidos de Equilíbrio Químico
Veja agora três questões resolvidas. Fácil; Médio; e Difícil são os três níveis para você acompanhar e aprender. Depois, têm mais exercícios para você resolver.
Confira agora com a professora Larissa Marques, do canal do Curso Enem Gratuito:
Exercícios sobre Equilíbrio Químico
Questão 1
(UFSM)
A amônia é uma matéria-prima básica para a síntese de fertilizantes.
A equação que representa a síntese da amônia é:
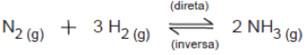
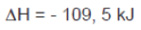
Sob pressão constante de 100 atm, observa-se que, com o aumento da temperatura, o rendimento da reação varia de acordo com o gráfico.
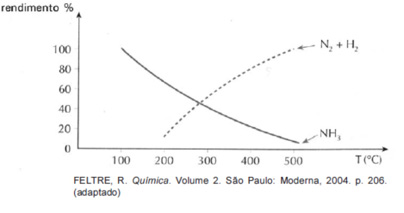
Com referência a essa reação, é correto afirmar:
a) Como a reação direta é exotérmica, o aumento da temperatura diminui o rendimento de NH3.
b) A temperatura não tem influência na formação da amônia.
c) O aumento da temperatura desloca o equilíbrio no sentido da reação direta.
d) Quanto maior a temperatura, menor a quantidade de N2 e H2 produzida pela reação inversa.
e) A diminuição da temperatura desloca o equilíbrio no sentido da reação inversa.
Dica 3 – Revise com a gente sobre as Propriedades coligativas das soluções nesta aula de Química Enem. O Exame Nacional do Ensino Médio está chegando! – https://blogdoenem.com.br/propriedades-coligativas-das-solucoes-quimica-enem/
Questão 2
A água é uma das mais importantes substâncias do planeta Terra, tanto para os processos vitais como para os físico-químicos. No estado líquido e sólido, cobre mais de dois terços do pleneta e, na forma gasosa, é constituinte da atmosfera. Os organismos vivos originaram-se em meio aquoso e se tornaram dependentes dele no decurso da evolução. A água é o solvente universal, pois possibilita a maioria das reações químicas. Assim, o conhecimento de suas propriedades físico-químicas é essencial para o estudo de suas funções na natureza.
REICHARDT, K, TIMM, L. C. Solo, Planta e Atmosfera: conceitos, processos e aplicações. São Paulo: Ed. Manole, 2004. (adaptado)
Considere a reação:
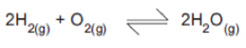
Considere a constante de equilíbrio K=1,24 x 1080, a 25ºC, para a reação citada. Pode-se, então, afirmar que
I. K>1 indica que o equilíbrio está deslocado no sentido de formação de H2O(g).
II. K é independente da temperatura.
III. K depende das concentrações de H2(g), O2(g) e H2O(g) no equilíbrio.
Está(ão) correta(s)
a) apenas I.
b) apenas II.
c) apenas III.
d) apenas I e II.
e) apenas I e III.
Questão 3
(UDESC) Em 1884, Henri Louis Le Chatelier descreveu um princípio que ficou conhecido como Princípio de Le Chatelier e anuncia: “quando algumas condições que determina o equilíbrio é modificada, o sistema responde, no sentido de amenizar a perturbação sofrida”. Exemplo disso é a água oxigenada, que se decompõe em água e oxigênio, segundo a reação em equilíbrio a seguir.
A mudança causada na reação em equilíbrio que favorece a formação dos produtos é o aumento da:
a) concentração de H2O2
b) concentração de H2O
c) concentração de O2
d) temperatura
e) pressão
Questão 4
(UDESC) O dióxido de nitrogênio (NO2(g)) é um dos gases responsáveis pela formação de chuva ácida. Calcule a constante de equilíbrio, em termos de concentração, para a reação de formação de NO2(g) a partir do óxido de nitrogênio (NO2(g)), sabendo que nas condições de temperatura e pressão em que se encontra o sistema existem as seguintes concentrações dos compostos no equilíbrio.
[NO] = 1,0 mol/L; [O2]= 1,5 mol/L; [NO2]= 0,1 mol/L
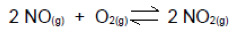
a) 1,5 mol/L
b) 0,0066 mol/L
c) 0,066 mol/L
d) 0,66 mol/L
e) 6,66 mol/L
Questão 5
(UDESC) Águas duras, são águas que apresentam alta concentração de cátions, principalmente Ca2+ e Ba2+, que ao reagirem com carbonato e sulfato, formam sais insolúveis.
Com relação às propriedades dos compostos pouco solúveis em equilíbrio com seus íons em solução aquosa, considere a seguinte reação:
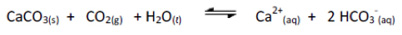
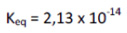
Analise as proposições sobre o valor da constante de equilíbrio estimada e de todos os equilíbrios envolvidos.
I- é possível dissolver o carbonato de cálcio sólido borbulhando dióxido de carbono gasoso à solução, pois o valor da constante de equilíbrio torna o processo favorável.
II- Constantes de equilíbrio maiores que 1 tendem a favorecer a posição do equilíbrio para os produtos.
III- Não é possível a dissolução completa do carbonato de cálcio sólido pela passagem de gás carbônico pela solução, como sugerido pelo baixo valor da constante de equilíbrio para a reação.
IV- A adição de bicarbonato de sódio no sistema reacional vai causar um deslocamento do equilíbrio para a direita.
V- A adição de CO2(g) ao sistema vai causar mais precipitação de carbonato de cálcio.
VI- A remoção do dióxido de carbono dissolvido na solução vai aumentar a solubilidade do carbonato de cálcio.
Assinale a afirmativa correta.
a) somente as afirmativas I e IV são verdadeiras.
b) somente as afirmativas II e III são verdadeiras.
c) somente as afirmativas II e V são verdadeiras.
d) somente as afirmativas III e V são verdadeiras.
e) somente as afirmativas II e VI são verdadeiras.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!