Confira no resumo quais são os fatores que influenciam nas Propriedades Coligativas: 1 - abaixamento da pressão de vapor (tonoscopia); 2 - elevação do ponto de ebulição (ebulioscopia); 3 - diminuição do ponto de congelamento (crioscopia); e 4 - pressão osmótica (osmoscopia).
As propriedades coligativas das soluções dependem apenas do número de partículas dispersas na solução, independentemente da natureza dessas. Dependem apenas do solvente.
Para você recuperar bem o conteúdo sobre as Propriedades Coligativas: Elas incluem: abaixamento da pressão de vapor (tonoscopia); elevação do ponto de ebulição (ebulioscopia); diminuição do ponto de congelamento (crioscopia) e pressão osmótica (osmoscopia).
Tonoscopia
É o abaixamento da pressão máxima de vapor de um líquido devido à presença de um soluto não-volátil. Veja na imagem que no recipiente “a” está o Solvente Puro; e no recipiente “b” estão o Solvente mais o Soluto. 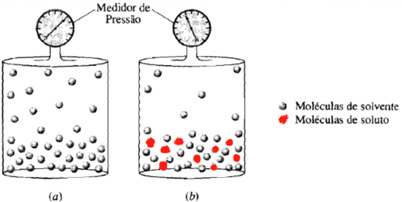 A pressão de vapor mede a tendência das moléculas de um solvente escapar para a atmosfera. A presença de algum soluto diminui essa tendência.
A pressão de vapor mede a tendência das moléculas de um solvente escapar para a atmosfera. A presença de algum soluto diminui essa tendência.
Aula de introdução: Pressão e Mudança de Fase
Veja um resumo simples e rápido com o professor Marcelo Alves, do Curso Enem Gratuito, que vai ajudar você a compreender o conteúdo completo desta revisão:
Muito bom este resumo. Agora, hora de prosseguir.
Lei de Raoult
A pressão parcial de vapor de um componente na solução líquida é proporcional à fração molar de cada componente volátil multiplicado pela pressão de vapor do componente puro.
p1 = X1 p10 ou p1 = (1-X2) p10
Onde p1 é a pressão parcial do componente 1, X1 (ou 1 – X2) é a fração molar do componente 1 e p10 é a pressão de vapor do componente 1 puro.
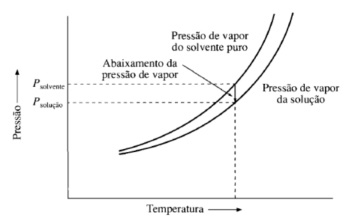
p0 – p1 = Δp = abaixamento absoluto da pressão máxima de vapor da solução
|
pº – p1 |
= |
Δp |
= |
abaixamento relativo da pressão máxima de vapor da solução |
|
p0 |
p0 |
Abaixamento da pressão máxima de vapor de uma solução
Ebulioscopia
É a elevação da temperatura de ebulição de um líquido ocasionada pela dissolução de um soluto não-volátil.
A elevação da temperatura de ebulição da solução (ΔTeb ) é a diferença entre a temperatura de ebulição da solução (T) e a temperatura de ebulição do solvente puro (T0).
ΔTeb = T – T0
Ela pode ser calculada pela Lei de Raoult
Numa solução diluída de um soluto não volátil, a elevação da temperatura de ebulição é diretamente proporcional à molalidade da solução.
ΔTeb = Keb x m (molalidade da solução)
Molalidade = nº mol do soluto/massa do solvente (kg)
Onde Kebé a constante ebulioscópica molal do solvente.
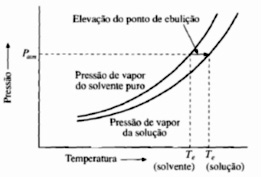
Elevação do ponto de ebulição de uma solução
Crioscopia
É o abaixamento da temperatura de congelamento de um líquido devido à dissolução de outras substâncias nele.
O abaixamento da temperatura de congelamento da solução (ΔTc) é a diferença entre a temperatura de ebulição do solvente puro (T0) e a temperatura de ebulição da solução (T).
ΔTc = T0 – T
Ela pode ser calculada pela Lei de Raoult
Numa solução diluída de um soluto não volátil, o abaixamento da temperatura de congelamento é diretamente proporcional à molalidade da solução.
ΔTc = Kc x m (molalidade do soluto)
Molalidade = nº mol do soluto/massa do solvente (kg)
Onde Kcé a constante crioscópica molal do solvente.
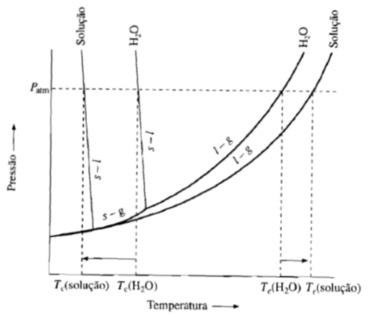
Abaixamento da temperatura de congelamento de uma solução
Osmoscopia
É a medida da pressão osmótica das soluções.
Pressão osmótica é a pressão que devemos exercer sobre a solução para impedir sua diluição, pela passagem do solvente puro, através de uma membrana semipermeável.
Quando aplicamos uma pressão igual a pressão osmótica, o solvente passa pela membrana semipermeável de forma que a variação de volume total da solução é igual a zero (não ocorrem passagem efetiva de solvente pela membrana semipermeável).
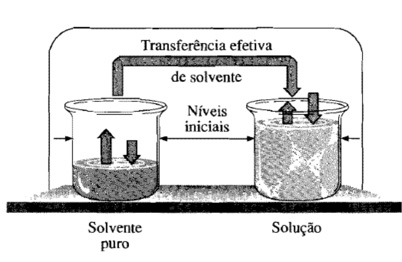
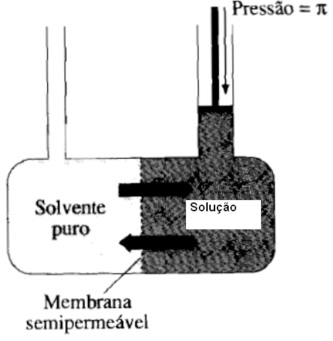
Cálculo da pressão osmótica
A pressão osmótica (π) é diretamente proporcional à molaridade da solução (n/V) e a temperatura absoluta (Kelvin). Sendo a constante de proporcionalidade igual à constante do gás ideal R.
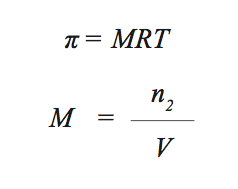
Classificação da solução
Considerando a mesma temperatura, com pressões osmóticas PA e PB.
- a solução A é hipertônica em relação à B, quando PA > PB
- a solução A é isotônica em relação à B, quando PA = PB
- a solução A é hipotônica em relação à B, quando PA < PB
Soluções iônicas x Soluções covalentes
Fator de Van’t Hoff (i)
i= 1 + α(q-1), onde α é o grau de dissociação do eletrólito e q é o número de partículas formadas pela ionização de cada molécula.
Eletrólitos – conduzem corrente elétrica em solução aquosa.
Não-eletrólitos – não conduzem corrente elétrica em solução aquosa.
Dissociação de eletrólitos iônicos.
São eletrólitos fortes, ou seja, liberam íons em solução aquosa.
Ex.:
NACl(s) → Na+(aq) + Cl–(aq)
Dissociação de eletrólitos moleculares.
Podem ser eletrólitos fortes e fracos, bem como não-eletrólitos.
Ex.: HCl e outros ácidos fortes são eletrólitos fortes.
HCl(g) → H+(aq) + Cl–(aq)
Exercício resolvido: Pressão e Mudança de fase:
Desafios
Questão 1
Através de um conhecimento empírico, as pessoas adicionam sal ao gelo, a fim de gelar bebidas mais rapidamente. Em termos científicos, a adição de sal à água faz com que a solução tenha ponto de fusão menor do que o da água pura. Tal fenômeno é chamado de:
a) tonoscopia.
b) osmoscopia.
c) crioscopia.
d) abaixamento da pressão de vapor.
e) ebulioscopia.
Dica 1 – Você sabe tudo sobre Concentração das Soluções? Revise com mais esta aula preparatória para a prova de Química Enem! – https://blogdoenem.com.br/concentracao-das-solucoes-quimica-enem/
Questão 2
A água pura tem temperatura de ebulição (Te) e temperatura de solidificação (Ts). Quando adiciona-se cloreto de sódio (NaCl), um soluto não volátil, as temperaturas de ebulição e solidificação para a solução resultante serão (Te’) e (Ts’), respectivamente. É correto afirmar que:
a) Te < Te’ e Ts < Ts’
b) Te < Te’ e Ts > Ts’
c) Te > Te’ e Ts > Ts’
d) Te = Te’ e Ts = Ts’
e) Te > Te’ e Ts < Ts’
Dica 2 – Relembre tudo sobre Dispersões em mais esta aula preparatória para a prova de Química Enem. Estude com a gente para o Exame Nacional do Ensino Médio! – https://blogdoenem.com.br/dispersoes-quimica-enem/
Questão 3
A panela de pressão permite que os alimentos sejam cozidos em água muito mais rapidamento do que em panelas convencionais. Sua tampa possui uma borracha de vedação que não deixa o vampo escapar, a não ser através de um orifíficio central sobre o qual assenta um peso que controla a pressão. Quando em uso, desenvolve-se uma pressão elevada no seu interior. Para a sua operação segura, é necessário observar a limpeza do orifício central e a existência de uma válvula de segurança.
O esquema da panela de pressão e um diagrama de fase da água são apresentados abaixo.
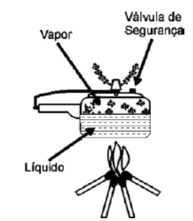
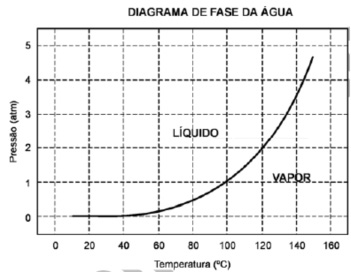
A vantagem do uso de panela de pressão é a rapidez para o cozimento de alimentos e isto se deve à:
a) pressão no seu interior, que é igual à pressão externa.
b) temperatura de seu interior, que está acima da temperatura de ebulição da água no local.
c) quantidade de calor adicional que é transferido à panela.
d) quantidade de vapor que está sendo liberada pela válvula.
e) espessura da sua parede, que é maior do que a das panelas comuns.
Dica 3 – Relembre tudo sobre as Fontes Energéticas em mais esta aula preparatória para a prova de Química Enem. Estude conosco para o Exame Nacional do Ensino Médio! – https://blogdoenem.com.br/fontes-energeticas-quimica-enem/
Questão 4
Ao adicionarmos 2g de sal (NaCl) à água, a temperatura de ebulição da solução formada é maior que a da água pura. Caso adicionássemos a mesma quantidade de NaBr ao invés de sal à água, a temperatura de ebulição da nova solução será:
a) a mesma da solução contendo NaCl.
b) a mesma que a da água pura.
c) maior que a da água pura e da solução contendo NaCl.
d) muito maior que a da água pura.
e) muito menor que a da água pura.
Questão 5
Utiliza-se solução de NaCl a 0,70 % em água destilada como soro fisiológico, para que o soro:
a) tenha a mesma pressão osmótica do sangue.
b) mantenha o pH do sangue.
c) seja uma solução homogênea com o sangue.
d) tenha a mesma pressão de vapor do sangue.
e) tenha a mesma densidade do sangue.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!




