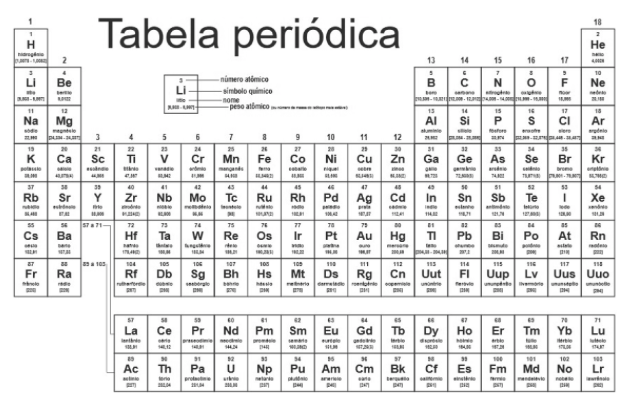
Teste seus conhecimentos sobre as características e classificação dos Elementos Químicos. Confira no resumo com lista de exercícios sobre a tabela periódica! Veja a revisão e resolva as questões.
Muitos estudantes ficam apavorados quando precisam resolver exercícios sobre tabela periódica. Geralmente isso ocorre porque achamos que teremos que decorar todos aqueles símbolos e números presentes na tabela.
Acontece que ela existe justamente para que não precisemos dessa “decoreba”. Entretanto, é importante compreender sua organização para poder utilizá-la da melhor forma. E, para você mandar bem nesse conteúdo, preparamos um pequeno resumo seguido de vários exercícios sobre tabela periódica para você testar seus conhecimentos em Química. Bora lá?
A tabela periódica
Muitas foram as tentativas ao longo da história de organizar os elementos químicos de forma coerente. Uma das mais bem sucedidas foi a tabela criada por Mendeleev, um cientista russo, no ano de 1989. Mendeleev organizou os elementos conhecidos na época em ordem crescente de seus números de massa em algumas
linhas. Além disso, nas colunas, ele agrupou elementos que compartilhavam características semelhantes. Entretanto, com o passar do tempo, os cientistas perceberam que o uso da massa atômica como referência não permitia uma periodicidade.
Sendo assim, em 1913, o cientista Henry G. J. Moseley compreendeu que uma melhor organização dos elementos se daria pela ordem crescente de seus números atômicos. Essa organização idealizada por Moseley guia a construção da tabela periódica atual.
Para saber um pouco mais sobre a história da tabela periódica, veja este resumo da professora Larissa Marques, do canal do Curso Enem Gratuito:
Propriedades periódicas: classificação dos elementos
Os elementos da tabela periódica podem ser classificados de acordo com as colunas, que representam grupos ou famílias de elementos químicos. Outra classificação é de acordo com as linhas da tabela periódica, que correspondem aos períodos. Enfim, existe também a setorização dos elementos da tabela periódica em metais, ametais e gases nobres.
A classificação dos elementos na tabela periódica também é chamada de propriedades periódicas.
Colunas: grupos ou famílias
Como você já deve ter reparado, na tabela periódica temos colunas e linhas. As colunas são chamadas de grupos ou famílias e são numeradas de 1 até 18.
Essas famílias contêm elementos que compartilham características entre si e têm uma regularidade na variação de propriedades físicas e químicas. Além disso, no caso dos grupos 1,2,13,14,15,16,17 e 18, os elementos pertencentes a essas famílias têm a última camada com o mesmo número de elétrons.
Algumas das famílias da tabela periódica recebem nomes especiais que aparecem recorrentemente no Enem e nos vestibulares:
- Família 1 – Família dos Metais Alcalinos.
- Família 2 – Família dos Metais Alcalinos Terrosos.
- Família 16 – Família dos Calcogênios.
- Família 17 – Família dos Halogênios.
- Família 18 – Família dos Gases Nobres.
Linhas: períodos
Na tabela periódica os elementos químicos estão organizados em 7 linhas, chamadas de períodos.
Essas linhas têm relação com o número de camadas eletrônicas apresentas pelo átomo. Sendo assim, um átomo que apresente as camadas K e L (2 camadas) estará disposto no período 2. Já um átomo que tenha elétrons nas camadas K, L, M, N, O, P e Q (7 camadas) estará no período 7.
Metais, ametais e gases nobres
Além da organização da posição dos elementos na tabela periódica, também temos uma organização por setorização. Sendo assim, temos 3 grandes setores na tabela periódica, geralmente pintados de cores diferentes: os metais, os ametais e os gases nobres.
Metais
Os metais são elementos químicos que, em geral, são sólidos a temperatura ambiente (exceto o mercúrio, que é líquido). Esses elementos são bons condutores de calor e energia elétrica. Além disso, são dúcteis e possuem brilho.
São elementos mais eletropositivos, ou seja, em ligações químicas tendem a perder elétrons, ficando carregados positivamente.
Ametais
Os ametais (ou não-metais), por sua vez, são elementos que não conduzem bem calor ou eletricidade. Possuem diferentes estados físicos em temperatura ambiente e não são maleáveis ou dúcteis.
Em geral, dizemos que são elementos com maior eletronegatividade, uma vez que tendem a ganhar elétrons em ligações químicas, ficando carregados negativamente.
Gases nobres
Gases nobres são todos gases em temperatura ambiente. Estão localizados na família 18 e sua principal característica é o fato de que são praticamente inertes. Ou seja, praticamente não reagem com outros átomos. Isso se deve ao fato de que possuem 8 elétrons na camada de valência.
Agora que você já revisou as principais características da tabela periódica, que tal aprendeu um pouco mais sobre o assunto com algumas dicas do professor Sobis?
Para finalizar e testar seus conhecimentos, faça os exercícios sobre tabela periódica selecionados pela professora Juliana!
Exercícios sobre tabela periódica
tabela periódica
Sumário do Quiz
0 de 9 questões completadas
Perguntas:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
Information
.
Você já fez este questionário anteriormente. Portanto, não pode fazê-lo novamente.
Quiz is loading...
You must sign in or sign up to start the quiz.
Para iniciar este questionário, você precisa terminar, antes, este questionário:
Resultados
0 de 9 perguntas respondidas corretamente
Seu tempo:
Acabou o tempo
Você conseguiu 0 de 0 pontos possíveis (0)
Categorias
- Sem categoria 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- Respondido
- Revisão
-
Pergunta 1 de 9
1. Pergunta
(ENEM MEC/2017)
No ar que respiramos existem os chamados “gases inertes”. Trazem curiosos nomes gregos, que significam “o Novo”, “o Oculto”, “o Inativo”. E de fato são de tal modo inertes, tão satisfeitos em sua condição, que não interferem em nenhuma reação química, não se combinam com nenhum outro elemento e justamente por esse motivo ficaram sem ser observados durante séculos: só em 1962 um químico, depois de longos e engenhosos esforços, conseguiu forçar “o Estrangeiro” (o xenônio) a combinar-se fugazmente com o flúor ávido e vivaz, e a façanha pareceu tão extraordinária que lhe foi conferido o Prêmio Nobel.
LEVI, P. A tabela periódica. Rio de Janeiro: Relume-Dumará, 1994 (adaptado).
Qual propriedade do flúor justifica sua escolha como reagente para o processo mencionado?
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo para acertar na hora da prova.
-
Pergunta 2 de 9
2. Pergunta
(ENEM MEC/2018)
Na mitologia grega, Nióbia era a filha de Tântalo, dois personagens conhecidos pelo sofrimento. O elemento químico de número atômico (Z) igual a 41 tem propriedades químicas e físicas tão parecidas com as do elemento de número atômico 73 que chegaram a ser confundidos. Por isso, em homenagem a esses dois personagens da mitologia grega, foi conferido a esses elementos os nomes de nióbio (Z = 41) e tântalo (Z = 73). Esses dois elementos químicos adquiriram grande importância econômica na metalurgia, na produção de supercondutores e em outras aplicações na indústria de ponta, exatamente pelas propriedades químicas e físicas comuns aos dois.
KEAN, S. A colher que desaparece: e outras histórias reais de loucura, amor e morte a partir dos elementos químicos. Rio de Janeiro: Zahar, 2011 (adaptado).
A importância econômica e tecnológica desses elementos, pela similaridade de suas propriedades químicas e físicas, deve-se a
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo para acertar na hora da prova.
-
Pergunta 3 de 9
3. Pergunta
(Uncisal AL/2020)
Dmitry Mendeleev, nascido na Rússia, formulou uma lei que ele denominou, em 1871, como periódica: quando dispostos de acordo com o valor de seus pesos atômicos, os elementos apresentam uma clara periodicidade de propriedades.
A tabela elaborada por Mendeleev, em consonância com a lei periódica por ele formulada, organizava os elementos em função
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo para acertar na hora da prova.
-
Pergunta 4 de 9
4. Pergunta
(Cefet MG/2020)
O ano de 2019 foi instituído pela Assembleia Geral das Nações Unidas e a UNESCO como o “Ano Internacional da Tabela Periódica dos Elementos Químicos”. Para comemorar esse evento, o CEFET/MG – Campus Belo Horizonte, apresenta em suas janelas uma exposição dos elementos que, juntos, formam a Tabela Periódica.

Fonte: Banca elaboradora
A respeito da organização periódica, é correto afirmar que os elementos
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo para acertar na hora da prova.
-
Pergunta 5 de 9
5. Pergunta
(UEG GO/2018)
No processo de evolução da tabela periódica, os modelos de Mendeleev e Moseley foram as formulações mais bem-sucedidas para demonstrar a periodicidade das propriedades dos elementos químicos. Nesse contexto, a diferença básica entre os modelos de Mendeleev e Moseley residem, respectivamente, na forma de organização dos seguintes parâmetros atômicos:
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo para acertar na hora da prova.
-
Pergunta 6 de 9
6. Pergunta
(IFMT/2018)
Na Tabela Periódica abaixo, estão identificados, através dos números 1, 2, 3, 4, 5, 6, 7, 8, 9, ……16, 17 e 18, todos os grupos dos elementos químicos.

(Disponível em: http://www.clickestudante.com/img-conteudo/0219C.gif).
Alguns desses grupos podem receber nomes, sendo que os dois primeiros grupos da Tabela Periódica são identificados nesta ordem, pelos nomes Metal Alcalino e Metal Alcalino Terroso, enquanto os três últimos grupos são denominados respectivamente de Calcogênios. Halogênios e Gases Nobres.
Considerando a Tabela Periódica e o enunciado, assinale a alternativa que contém os símbolos dos elementos químicos pertencente, respectivamente, aos grupos dos Calcogênios, Halogênios e Gases Nobres.
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo para acertar na hora da prova.
-
Pergunta 7 de 9
7. Pergunta
(FPS PE/2017)
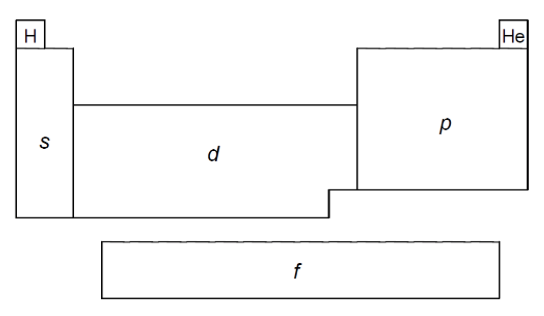
A tabela periódica é um arranjo tabular dos elementos químicos, ordenada por seu número atômico (número de prótons), configurações eletrônicas e propriedades químicas recorrentes. Esta ordenação mostra as tendências periódicas, como elementos com comportamentos semelhantes. De acordo com a disposição dos átomos da tabela periódica, agrupados de acordo com a localização do elétron de menor energia nos orbitais s, p, d e f, três afirmações foram feitas:

- Os elementos posicionados nos agrupamentos s e d são chamados de metais.
- Alguns elementos posicionados no agrupamento p são chamados halogênios e gases nobres.
- Os elementos posicionados no agrupamento f são chamados de lantanídeos e actinídeos.
Está(ão) correta(s):
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo para acertar na hora da prova.
-
Pergunta 8 de 9
8. Pergunta
(ETEC SP/2017)
Em uma aula de Química e para apresentar a Tabela Periódica de uma forma lúdica, o professor propôs um jogo.
Grupos de quatro alunos foram formados, cada grupo recebeu uma Tabela, um dado e cada aluno recebeu uma peça colorida.
Algumas das regras do jogo são:
- Para mover sua peça o aluno joga um dado e o número obtido é a quantidade de casas (elementos), que ele deve se deslocar na Tabela.
- O aluno só pode deslocar sua peça em uma única direção, vertical ou horizontal (a cada jogada).
- Vence o jogo quem chega com a sua peça no elemento químico de número atômico 118.
Se o professor desse o comando: “Coloquem suas peças sobre os gases nobres”, os alunos deveriam colocá-las sobre elementos cujo grupo (ou família) na Tabela Periódica é identificado pelo número
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo para acertar na hora da prova.
-
Pergunta 9 de 9
9. Pergunta
(UNITAU SP/2016)
Um elemento químico X apresenta configuração eletrônica 1s2 2s2 2p4. Podemos afirmar que, na tabela periódica, esse elemento químico está localizado no
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo para acertar na hora da prova.