Metais alcalinos, calcogênios, halogênios e gases nobres: revise nesta aula de Química Enem. Veja como é fácil localizar os elementos químicos na Tabela Periódica. Confira a Classificação dos Elementos na aula abaixo.
Desvende os Mistérios da Tabela Periódica. Veja as Propriedades Periódicas dos Elementos Químicos: abaixo. Confira também os temas que mais caem nas questões de Química no Enem.
Como critérios para a classificação dos elementos químicos dentro da Tabela Periódica de Mendeleev, utilizam-se as semelhanças entre as suas propriedades físicas e químicas, que estão associadas ao número de elétrons na camada de valência. Esta é a formulação que gera os padrões da Tabela Periódica. Achou complicado? Vamos traduzir para você mandar bem no Enem e no Vestibular.
Desde o início do século XIX, várias tentativas, sem grande sucesso, foram feitas para organizar os elementos. O trabalho mais detalhado foi feito em 1869, na cidade de São Petersburgo, pelo químico russo Dmitri Mendeleev (1934 – 1907). Este químico classificou os elementos em ordem crescente de massa atômica, respeitando as propriedades químicas. 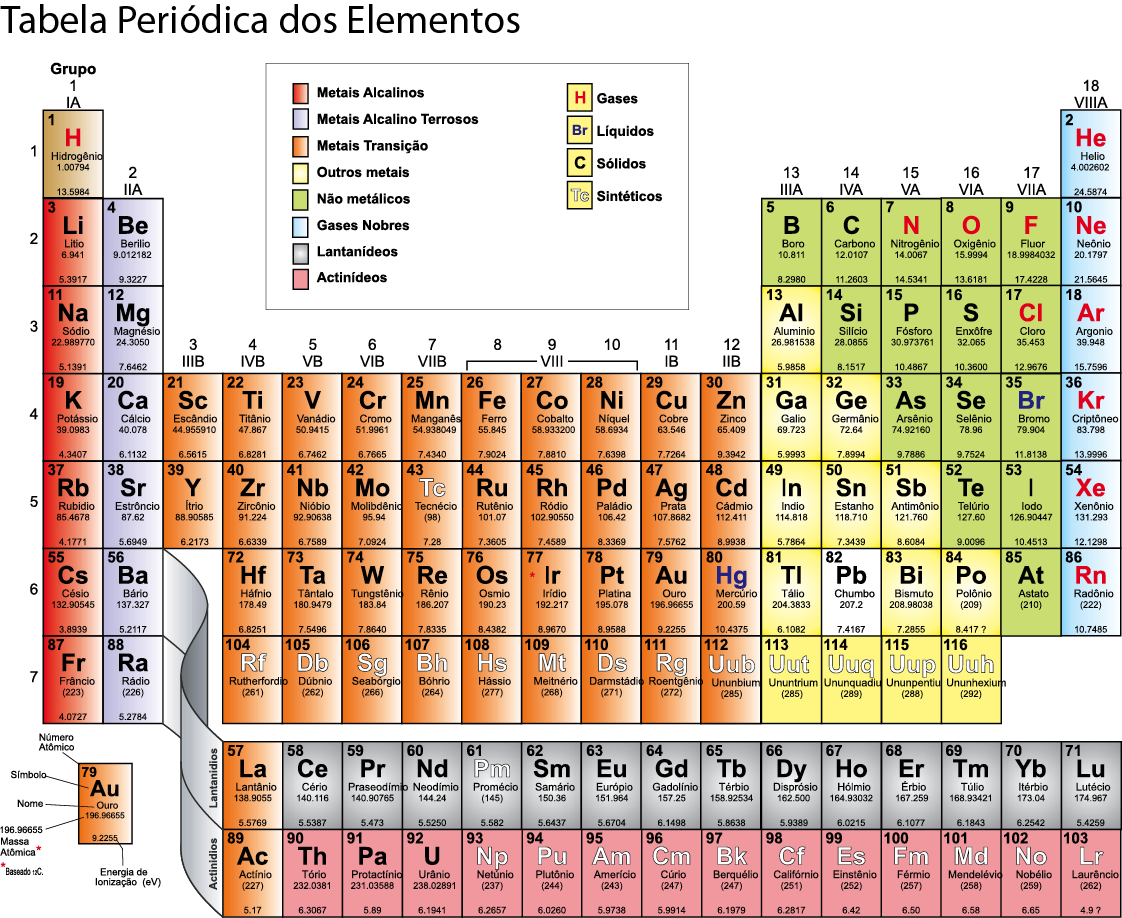 Com o conhecimento da estrutura atômica, ficou demonstrado que a identidade de um elemento químico está relacionada com o seu número de prótons. Isso implicou numa reformulação da Tabela Periódica. Veja na imagem acima a atual da Tabela Periódica:
Com o conhecimento da estrutura atômica, ficou demonstrado que a identidade de um elemento químico está relacionada com o seu número de prótons. Isso implicou numa reformulação da Tabela Periódica. Veja na imagem acima a atual da Tabela Periódica:
A Tabela Periódica atual
Dentre os 109 elementos conhecidos, temos os naturais, que constituem a matéria do nosso mundo físico, e os artificiais, que foram obtidos em laboratórios de pesquisa nuclear. Existem cerca de 1730 elementos atualmente. Esse número compreende os isótopos de todos os átomos.
Os Períodos
Denomina-se período cada uma das linhas da tabela. O número do período corresponde ao número de camadas ocupadas pelos elétrons. No Primeiro Período, eletrons até à 1ª camada. No Segundo Período, elétros até à 2ª Camada, e assim por diante. Daí termos sete períodos. Veja: 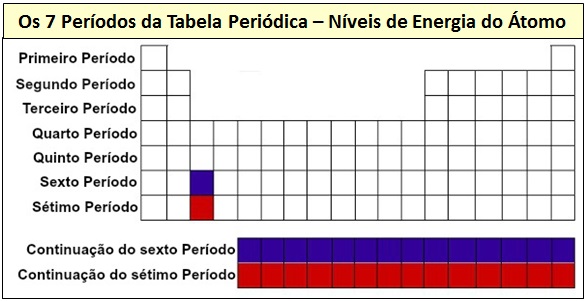 Observe na imagem acima como você pode ‘ler e interpretar’ a Tabela Periódica.
Observe na imagem acima como você pode ‘ler e interpretar’ a Tabela Periódica.
As Famílias da Tabela Periódica
As dezoito colunas da tabela são denominadas famílias ou grupos. Os elementos que pertencem a uma mesma família apresentam propriedades químicas semelhantes, pois possuem a mesma quantidade de elétrons na ultima camada.
Modernamente, as famílias são numeradas de 1 a 18, eliminando-se o uso das letras. Observamos na tabela que as famílias são designadas pelas letras A e B.
As Famílias indicadas pela letra A e a família zero recebem denominações especificas. Veja:
• Família 1 (1A): metais alcalinos
• Família 2 (2A): metais alcalinos terrosos
• Família 13 (3A): família do Boro
• Família 14 (4A): família do carbono
• Família 15 (5A): família do nitrogênio
• Família 16 (6A): calcogênios
• Família 17 (7A): halogênios
• Família 18 (0): gases nobres
Estude com uma videoaula bem simples sobre as propriedades da tabela periódica
Veja os Fundamentos da Tabela Periódica:
A Tabela Periódica permite, por exemplo, prever o comportamento de átomos e das moléculas deles formadas, ou entender por que certos átomos são extremamente reativos enquanto outros são praticamente inertes.
Os Fundamentos da Tabela Periódica:
- Os elementos químicos estão ordenados da esquerda para a direita, em ordem crescente de numero atômico (ex: H (z=1), He (z=2), Li (z=3), Be (z=4) …)
- A linha vertical ou coluna na tabela periódica corresponde a uma família ou grupo de elementos químicos que apresentam uma regularidade na variação de propriedades químicas e físicas e mesmo número de elétrons na sua camada de valência. Por exemplo: Os elementos da família 1, 2 e de 13 a 18, que eram antigamente representados pelos grupos 1A, 2A, 3A, 4A, 5A, 6A, 7A, e 8A apresentam 1, 2, 3, 4, 5, 6,7 e 8 elétrons na sua camada de Valência, respectivamente.
- Existem dois tipos diferentes de grupos, o dos elementos representativos (representados pelos grupos 1A a 8A) e o dos elementos de transição (localizados na região central da tabela periódica). Os lantanídeos e os actinídeos são conhecidos como elementos de transição interna.
- O desenho abaixo apresenta a tabela periódica. Agora, leia novamente os fundamentos e vá relacionando a leitura com a imagem da Tabela.
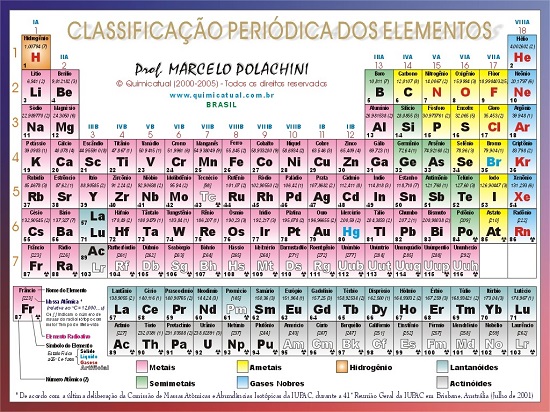
Dica Extra – Plano de Estudo de Química para o Enem – Veja aulas completas de revisão com os 10 temas de Química que mais caem nas provs do Exame Nacional do Ensino Médio. Confira: Plano de Estudos de Química: 
Gostou da explicação sobre as características da tabela periódica? Assista agora outro vídeo da Khan Academy em que o professor Salman Khan explica mais sobre a tabela periódica e a localização dos seus elementos. Não deixe de conferir!
Hidrogênio – O elemento químico mais abundante
O hidrogênio é diferente de todos os outros elementos e deveria ser colocado isoladamente na tabela periódica, portanto deveria ser colocado isoladamente na tabela; contudo, ele aparece na família 1A por apresentar um elétron no subnível s na sua única camada. Na imagem a seguir veja aula gratuita sobre os três isótopos do Hidrogênio: Prótio, Deutério, e Trítio.

Em certas tabelas o elemento hidrogênio está colocado na família 7A pois ele é um não-metal. A família 8B corresponde a três colunas: famílias 8, 9, 10. Depois temos a 3 (3B), 4 (4B), 5 (5B), 6 (6B), 7 (7B), 11 (11B) e 12 (12B). Veja uma aula completa sobre os Isótopos do Hidrogênio, e as características do Elemento que está na água e que pode ser o combustível ecológico do futuro.
Dica do Blog – Para gabaritar em Química no próximo Enem, relembre nesta aula os modelos atômicos e as partículas fundamentais, como o Átomo. Revisão desde o modelo de Demócrito e Leucipo, John Dalton, Thomson, Rutherford, e Niels Bohr:
Subdivisão da Tabela Periódica
Uma outra classificação que pode ser atribuída aos elementos químicos é quanto as suas propriedades.
• Metais: Apresentam brilho, são bons condutores de calor e eletricidade, são maleáveis, apresentam dureza e tenacidade, possuem densidade e pontos de fusão e ebulição altos.
• Semimetais: São elementos que apresentam propriedades intermediárias entre os metais e os não-metais (possuem pouca tendência a perder elétrons e formar cristais como os metais, não são bons condutores de eletricidade e calor).
• Não-metais: Não apresentam brilho, dão origem a substâncias moleculares, não apresentam maleabilidade e possuem na sua maioria pontos de fusão e ebulição baixos.
Configuração eletrônica da Tabela Periódica
• Se o subnível mais energético é o s ou o p da ultima camada, dizemos que o elemento é representativo; famílias do grupo A. Neste grupo podemos localizar os elementos na tabela partindo do número de elétrons que o elemento possui na última camada.
Ex: 11Na = 1s2 2s2 2p6 3s1 → 3 elétrons na última camada = família 3A
• Se o subnível mais energético é o d da penúltima camada, dizemos que o elemento é de transição externa. Entretanto, se o subnível mais energético é o f da antepenúltima camada, dizemos que o elemento é de transição interna.
Como conseqüência da distribuição dos elementos na tabela periódica segundo o número atômico, as propriedades químicas e a configuração eletrônica, podemos caracterizá-los sob um novo aspecto.
Localização de um elemento na tabela periódica
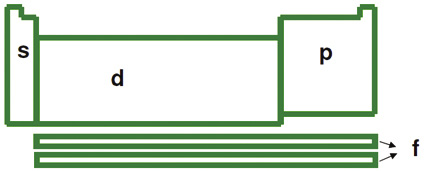
Conhecendo um pouco sobre distribuição eletrônica e organização da tabela periódica, é possível você localizar a maioria dos elementos químicos.
Exemplo: Um elemento X com número atômico 12: 1s2 2s2 2p6 3s2
• a sua última camada de energia é a 3ª, então esse elemento está no 3º período.
• possui 2 elétrons na última camada, então está na família 2A.
• nos elementos de transição, o número de elétrons deverá ser visto nos subníveis d caso seja transição externa e f transição interna.
Dica 2 – Sabe tudo sobre os tipos de matéria, fenômenos físicos e químicos? Relembre com esta aula de Química sobre as Propriedades da Matéria e garanta sua nota no próximo Enem! 
Aula Gratuita sobre Tabela Periódica
Antes de fazer os exercícios abaixo complete a sua revisão sobre as Propriedades dos Elementos Químicos e a organização da Tabela Periódica com este vídeo do professor Salman Khan. É uma excelente síntese. É conferir e nunca mais esquecer:
Veja o que mais cai de Química no Enem
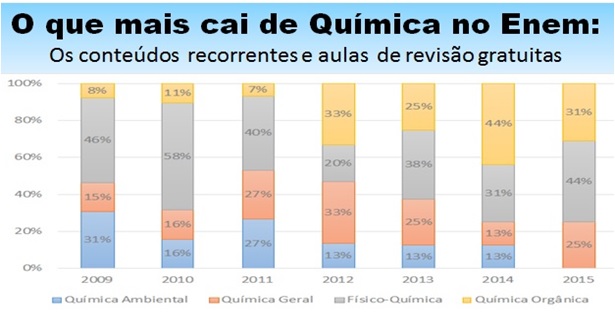
O professor Franco Ramunno, do Colégio Bandeirantes e São Paulo, pesquisou as provas do Enem e identificou os temas que mais caem nas questões de Química. Ele separou as questões em quatro grandes áreas mais importantes nas provas do Enem: 1 – Química Geral, 2 – Físico-Química; 3 – Química Orgânica; e, 4 – Química Ambiental. Veja uma aula completa com os temas que mais caem de Química no Enem.
1 – Química Geral
A Química Geral engloba o estudo da estrutura dos átomos e compostos químicos, com foco nos tipos de ligações químicas e, nos compostos moleculares, nos tipos de interações intermoleculares; também trabalha com as principais classes de substâncias inorgânicas (ácidos, bases, sais e óxidos) e suas reações, bem como os aspectos quantitativos das reações químicas (estequiometria).
2- Físico-Química
A Físico-Química relaciona conceitos oriundos da Física à Química, para tratar do estudo das soluções (principalmente as aquosas), das transferências de energia envolvidas nos processos químicos, da velocidade das reações, do equilíbrio químico e da eletroquímica.
3 – Química Orgânica
A Química Orgânica estuda, principalmente, a Química do Carbono, focando na estrutura dos compostos orgânicos (hidrocarbonetos, álcoois, aldeídos, ácidos carboxílicos, aminas, etc) e suas principais reações, além de englobar também o estudo da Bioquímica (carboidratos, proteínas e lipídios).
4 – Química Ambiental
A Química Ambiental trata de temas como poluição, aquecimento global, destruição da camada de ozônio e reciclagem. Confira a distribuição de itens de Química nos últimos 7 anos nessas quatro “áreas”. Clique na imagem.
Desafios para você responder e compartilhar sobre a Tabela Periódica
Questão 01
(PEIES – UFSM – 2009).
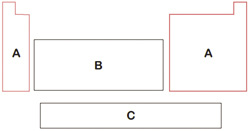
CARVALHO, Geraldo Camargo de; SOUZA, Celso Lopes de. Química de olho no mundo do trabalho. São Paulo: Scipione, 2003, p.53.
Na representação da Tabela Periódica, as letras A, B e C equivalem, respectivamente, aos
a) elementos representativos, metais de transição interna, metais de transição externa.
b) elementos representativos, metais de transição externa, metais de transição interna.
c) metais de transição interna, elementos representativos, metais de transição externa.
d) metais de transição externa, elementos representativos, metais de transição interna.
e) metais de transição externa, metais de transição interna, elementos representativos.
Questão 02
(UFF 2010- adaptado) Após os trabalhos de Lavoisier, Dalton e outros, o estudo dos elementos químicos desenvolveu-se de tal forma que se tornou necessário classificá-los de acordo com suas propriedades. A observação experimental tornou evidente que certos elementos têm propriedades muito semelhantes, o que permite reuni-los em grupos. Desde o século XIX, várias tentativas foram feitas, sem grande sucesso. O trabalho mais detalhado foi feito em 1869 por Mendeleev. Ele ordenou os elementos em função de suas massas atômicas crescentes, respeitando suas propriedades químicas. O trabalho foi tão importante que ele chegou a prever a existência de elementos que ainda não haviam sido descobertos. Com base na tabela periódica, é incorreto afirmar:
a) a energia de ionização de um elemento é a energia mínima necessária para remover um elétron do átomo desse elemento no estado gasoso
b) os elementos de transição interna são aqueles cujo subnível de maior energia da distribuição eletrônica de seus átomos é f.
c) a afinidade eletrônica ou eletroafinidade é a energia associada ao ganho de um elétron num átomo do elemento no estado gasoso.
d) a família 1 da tabela periódica refere-se aos metais alcalinos.
e) as propriedades dos elementos são funções aperiódicas de seus números atômicos.
Questão 03
(PUC-MG) Referente a tabela periódica
Os elementos que apresentam maiores energias de ionização são da família dos:
a) metais alcalino-terrosos.
b) gases nobres.
c) halogênios.
d) metais alcalinos.
e) halogênios
Dica 3 – Você sabe quais os tipos de ligações químicas estabelecidas entre os átomos para formar as moléculas? Que tal relembrar? O Enem está próximo, então estude com a gente! – https://blogdoenem.com.br/enem-ligacoes-quimicas/
Questão 04
(UNIMEP-SP adaptado) Um determinado elemento químico está situado no quarto período da tabela periódica e pertence à família dos halogênios. Qual o seu número atômico?
a)19
b)20
c)34
d)35
e)36
Questão 05
(Enem adaptado) O ferro pode ser obtido a partir da hematita, minério rico em óxido de ferro, pela reação com carvão e oxigênio.
Quanto ao elemento ferro é correto afirmar.
a) é um semimental.
b) é um metal da família dos metais alcalinos terrosos.
c) é um metal de transição interna.
d) é um metal de transição externa.
e) é um metal representativo.

Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!



