Veja os tipos de ligações químicas estabelecidas entre os átomos para formar as moléculas. É conteúdo certo no Enem e no Vestibular. Então, estude com a gente. Veja abaixo.
igações químicas são uniões estabelecidas entre átomos para formarem moléculas. Ou, no caso das ligações iônicas ou metálicas, para formar aglomerados atômicos organizados de forma a constituírem a estrutura básica de uma substância ou compostos. Achou difícil? – Então, é mesmo hora de revisar. Confira abaixo.
Vamos começar pelo básico das ligações quínicas: A união estabelecida entre átomos não ocorre de qualquer forma, devendo haver condições apropriadas para que a ligação entre eles ocorra, tais como: afinidade, contato, energia, etc.
Introdução às Ligações Químicas
Veja os tipos de ligações químicas existentes entre os átomos e de que maneira essas ligações ocorrem? Assista agora ao vídeo do Curso Enem Gratuito e não esqueça mais o conteúdo!
Ainda ficou com dúvida? O blog do Enem preparou um “resumão” pra você mandar muito bem nas questões sobre ligações químicas na prova do Enem e nos vestibulares.
Por que acontecem as Ligações Químicas?
A pergunta para motivar o seu aprendizado sobre ligações químicas iónicas, covalentes, ou metálicas é esta: – Por que o átomo possui a tendência de realizar ligações químicas? E por que determinados átomos se sentem mais atraídos em realizar ligações com átomos de certos elementos do que com outros?
Bom, as ligações químicas se estabelecem entre os elétrons da camada mais externa da eletrosfera (camada de valência). Para tanto, duas características são essenciais:
- A força de atração eletrostática que existe entre as cargas elétricas de sinais opostos;
- A tendência que os elétrons têm de formar pares.
Em 1916, Gilbert N. Lewis e Walter Kossel observaram que, na natureza, apenas os gases nobres (elementos da família 18, VIIIA ou 0 da tabela periódica) eram encontrados isolados na natureza.
Isso acontecia porque eles tinham uma característica que os outros átomos não tinham: todos os elementos dessa família (com exceção do hélio, que tem apenas uma camada eletrônica) possuem a camada de valência de seus átomos preenchida com oito elétrons.

Assim eles criaram a Regra do Octeto:

Vamos relembrar os tipos de ligações químicas existentes entre os átomos?
Ligações iônicas:
As Ligações Iônicas, como o próprio nome diz acontece entre íons, para que se atraiam esses íons deve ter cargas opostas, como o NaCl que é formado pelo cátion Na+ e o âniom Cl-.
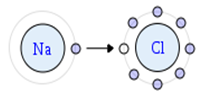
O átomo de sódio doa um elétron para o átomo de cloro, assim ambos completam a sua camada de valência.
Ligações covalentes:
Ligações Covalentes – Esse tipo de ligações químicas ocorrem pelo compartilhamento de elétrons da camada de valência dos átomos envolvidos, como a molécula de água.
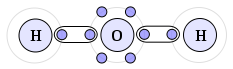
O átomo de oxigênio necessita de dois elétrons para ficar estável e o hidrogênio irá compartilhar seu elétron com esse átomo. Sendo assim o oxigênio ainda necessita de um elétron para se estabilizar, então é preciso de mais um hidrogênio, e esse,também compartilha seu elétron com o oxigênio, estabilizando-o.
Ligações metálicas:
As Ligações Metálicas são aquelas em que os elétrons da última camada não ficam restritos ao respectivo átomo, mas circulam por todo o material.
Introdução às Ligações Metálicas
Veja agora com a professora Larissa Campos, do canal do Curso Enem Gratuito, um resumo inicial para você dominar as Ligações Metálicas:
Esse modelo de ligação é conhecido como modelo do “mar de elétrons”, pois os cátions metálicos estão imersos nos elétrons livres. São estas, portanto, as Ligações Químicas Metálicas.
Modelo de ligação metálica:
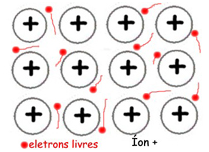
Nuvem de elétrons ou mar de elétrons
Confira agora um resumo das três ligações químicas:

Dica 1 – Veja o que mais cai em Química no Enem, e as principais dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Ainda ficou com dúvida? O blog do Enem preparou um “resumão” pra você mandar muito bem nas questões sobre ligações químicas na prova do Enem e nos vestibulares, Não deixe essa chance passar!
Dica 2: Veja também outro assunto de química bastante cobrado no enem e nos vestibulares que é diagrama de fases. Não deixe essa chance passar! https://blogdoenem.com.br/quimica-diagrama-de-fases/
Dica 3 – Complemente seus estudos de Ligações químicas acessando o nosso Blog do Enem e conferindo um super-resumo preparado especialmente para você sobre a matéria. Não deixe de estudar! https://blogdoenem.com.br/quimica-definir-materia/
Agora um desafio para você, teste o seu conhecimento!
(PUC – PR) Dados os compostos:
I – Cloreto de sódio
II – Brometo de hidrogênio
III – Gás carbônico
IV – Metanol
V – Fe2O3
Apresentam ligações covalentes os compostos:
A) I e V
B) III e V
C) II, IV e V
D) II, III e IV
E) II, III, IV e V
Resposta: D
Dica 4 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.


