Veja agora como resolver as questões mais difíceis da Química no Enem. A Geometria Molecular pode fazer a diferença na sua nota. Veja agora aula gratuita, com bônus de Polaridade.
Geometria Molecular – Você lembra das aulas do Ensino Médio? É sempre hora de revisar. Vamos lá. o primeiro passo é ver um resumo do Curso Enem Gratuito, com o professor Felipe Sobis, um campeão de Química na Internet.
Resumo de Geometria molecular
Veja as dicas de Geometria Molecular do Professor Sobis:
- A geometria molecular explica como ocorre a organização espacial dos átomos dentro de uma molécula.
- Cada molécula apresenta uma forma geométrica característica da natureza das ligações e dos seus constituintes. O tipo de geometria de uma molécula é importante para identificar várias propriedades das substâncias.
- Para determinar o tipo de geometria molecular deve-se conhecer o princípio da Teoria da Repulsão dos pares eletrônicos da camada de valência, desenvolvida pelo cientista inglês Ronald James Gillespie.
- Segundo esta teoria, o átomo central está rodeado por 2, 3, 4 ou mais pares de elétrons.
- Esses pares de elétrons existem ao redor do átomo central e orientam a geometria da molécula, prevendo ângulos entre as ligações e determinando a posição dos outros átomos em relação ao átomo central.
Moléculas diatômicas – São sempre lineares (geometria linear) –ângulo de ligação = 180º as Moléculas Diatômicas. veja na representação:
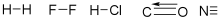 Exemplos de Moléculas Diatômicas: H2 (gás hidrogênio – usado em combustível de foguete espacial), F2, CO, N.
Exemplos de Moléculas Diatômicas: H2 (gás hidrogênio – usado em combustível de foguete espacial), F2, CO, N.
Moléculas triatômicas – São denominadas Moléculas Triatômicas aquelas que possuem geometria linear quando o átomo central não possui nenhum par de elétrons não ligantes – ângulo de ligação = 180º. Veja na representação: 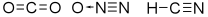
Exemplos de Moléculas Triatômicas: CO2, N2O, HCN
A Geometria das Moléculas Triatômicas: Possuem geometria angular quando o átomo central possui um (ou 2) par(es) de elétrons não ligantes – ângulo de ligação ≈ 105º
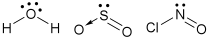
Exemplos: H2O, SO2, NOCl (hipoclorito de sódio – comum em alvejantes).
Moléculas Tetratômicas
- Possuem geometria trigonal planar quando o átomo central não possui nenhum par de elétrons não ligantes – ângulo de ligação ≈ 120º
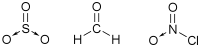
Ex: SO3, CH2O (formaldeído – “formol” – carcinogênico – presente em produtos para alisamento de cabelos), NO2Cl
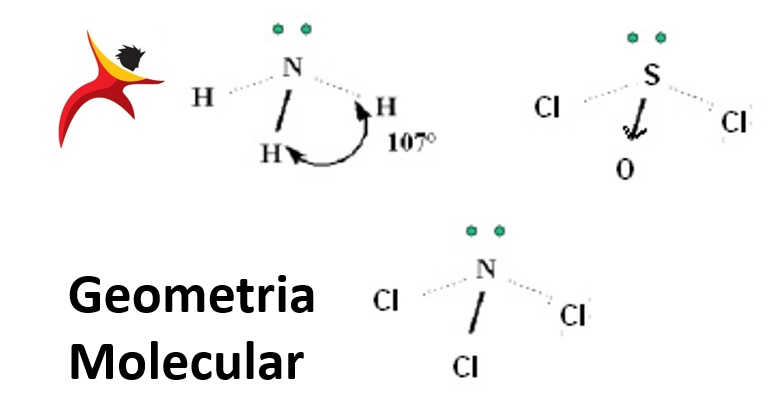
- Possuem geometria piramidal quando o átomo central possui um par de elétrons não ligantes – ângulo de ligação ≈ 107º para a amônia
Ex: NH3 (amônia – usada em fertilizantes para o solo), NCl3, SOCl2
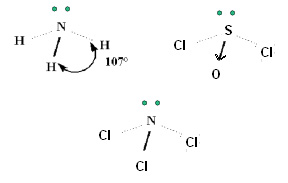
Ex: NH3 (amônia – usada em fertilizantes para o solo), NCl3, SOCl2.
Moléculas pentatômicas
Possuem geometria tetraédrica – ângulo de ligação ≈ 109,5º
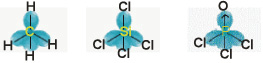
Ex: CH4, SiCl4, POCl3
Polaridade das moléculas.
Momento dipolo – μ = diferença entre as eletronegatividades
a) Moléculas Polares
- Diatômicas: formadas por átomos diferentes. Ex: HCl, HF, etc.
- Molécula em que sobram elétrons no átomo central. Ex: H2O, NH3, etc.
- Moléculas assimétricas.
b) Moléculas Apolares
- Diatômicas: formadas por átomos iguais. Ex: O2, N2, etc.
- Substâncias simples: O3, P4, S8, etc.
- Moléculas poliatômicas em que não sobram elétrons no átomo central. Ex. CO2, CH4
- Moléculas simétricas.
Saiba mais sobre Polaridade Molecular com as aulas do professor Felipe Sobis, do Curso Enem Gratuito:
As dicas do professor Sobis:
- As ligações entre átomos ocorrem para formar uma molécula. Para isso, é necessário que, pelo menos, dois átomos se unam.
- Quando isso ocorre, há uma grande movimentação dos elétrons, que se concentram nos pólos positivos e nos pólos negativos.
- Essa polaridade representa a capacidade que as ligações possuem de atrair cargas elétricas. A polaridade é importante para determinar certas características das moléculas como:
- ✔️ solubilidade;
- ✔️ força intermolecular: é a forma como as moléculas das – substâncias interagem, e determina;
- ✔️como essas substâncias irão se dissolver;
- ✔️ ponto de fusão: passagem do estado sólido para o estado líquido;
- ✔️ ponto de ebulição: passagem do estado líquido para o estado gasoso.
Momentos dipolares de algumas moléculas diatônicas:
|
Molécula |
Momento dipolar, D* |
|
|
Hidrogênio, H2 |
μ = 0 |
Molécula apolar |
|
Cloro, Cl2 |
μ = 0 |
Molécula apolar |
|
Ácido bromídrico, HBr |
μ = 0,8 |
Molécula polar |
|
Ácido clorídrico, HCl |
μ = 1,1 |
Molécula polar |
Veja agora uma aula-bônus sobre Geometria Molecular Avançada.
Desafios sobre Geometria Molecular
Questão 1
(PEIES –UFSM – 2008)
Observe as duas colunas a seguir
1- NH3
2- H2O
3- O2
4- CO2
(a) geometria linear
(b) geometria angular
(c) geometria piramidal
A alternativa que relaciona, corretamente, a primeira coluna com a segunda.
a) 1b-2a-3c-4a.
b) 1a-2c-3a-4b
c) 1b-2a-3b-4c
d) 1a-2b-3b-4c
e) 1c-2b-3a-4a
Dica 1 – Revise sobre Química Orgânica, entenda a função dos Hidrocarbonetos, suas classificações e nomenclaturas em mais uma aula de Química Enem – https://blogdoenem.com.br/quimica-organica-hidrocarbonetos-quimica-enem/
Questão 2
A borana (BH3 ) é um agente redutor forte, utilizando em síntese orgânica para a redução de aminoácidos à aminoálcoois.
Pode-se afirmar sobre a borana:
a) possui geometria trigonal planar
b) é uma molécula apolar
c) possui ângulo de ligação de 180º
d) apresenta momento dipolo
e) faz ligações dipolo dipolo-dipolo dipolo com a molécula de água.
Dica 2 – Revise tudo sobre Química Orgânica, as principais características do carbono e suas classificações em mais uma aula de Química Enem – https://blogdoenem.com.br/quimica-organica-quimica-enem/
Questão 3
(PEIES – UFSM – 2009)
O enxofre existe em várias formas alotrópicas, sendo a mais comum e a mais estável o sólido amarelo, conhecido desde a antiguidade, cuja fórmula molecular é S8.
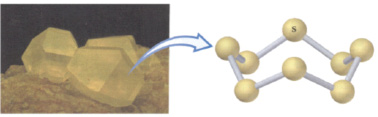
BROWN, Theodore L; LEMAY, H. Eugene; BURSTEN, Bruce E. Química, a ciência cental. São Paulo: Pearsc
Considerando as informações:
I. A estrutura apresenta momento dipolar
II. A ligação iônica une os átomos de enxofre
III. Cada átomo de enxofre está com o octeto completo
Está(ão) correta(s)
a) apenas I
b) apenas II
c) apenas III
d) apenas I e II
e) apenas I e III
Dica 3 – Você sabia que as soluções podem ser líquidas, sólidas e gasosas? Revise tudo sobre o Coeficiente de Solubilidade em mais uma aula de Química Enem – https://blogdoenem.com.br/coeficiente-de-solutilidade-quimica-enem/
Questão 4
O ácido cianídrico (HCN) é um ácido altamente tóxico. Devido à forte interação dos íons CN- com a hemoglobila, a mesma fica inativa para o transporte de oxigênio para dentro do corpo e dióxido de carbono para fora, causando morte por asfixia. O mesmo foi e é usado em câmeras letais.
Quanto à molécula de HCN é correto dizer:
a) a geometria da molécula é tetraédrica
b) a molécula é apolar
c) o átomo de carbono possui hibridização sp2
d) a molécula é linear
e) o ângulo de ligações é de 120º.
Questão 5
Segundo as seguintes moléculas: HCl; H2; CO; CO2 , podemos afirmar:
a) as moléculas de H2 e CO2 são apolares
b) todas as moléculas são polares
c) todas as moléculas são apolares
d) apenas H2 é apolar
e) apenas CO e CO2 são apolares.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!