É fácil medir o peso de qualquer coisa. Mas, agora, abra a cabeça e imagine só a dificuldade que é medir o peso de um átomo. Tem jeito sim. Veja a solução nas Grandezas Químicas nesta aula de Química Enem.
Você lembra das aulas sobre Grandezas utilizadas na Química? Veja como indicar ‘o peso atômico’ ou a Massa de um átomo:
Quando queremos medir a massa de uma barra de chocolate, devemos utilizar uma medida padrão. No caso do Brasil, utiliza-se o quilograma (múltiplos e submúltiplos). Já os ingleses medem a massa em libras (que corresponde a 0,454 kg). Na especificada da Química dos átomos, seria quase impossível a infinidade de zeros depois da vírgula para representar o peso de um átomo. A solução foi encontrada com as Grandezas Químicas.
No caso do átomo, portanto, utiliza-se o seguinte procedimento para a indicação da Massa Atômica:
- Unidade de massa atômica (u): é igual a 1/12 da massa de um átomo do isótopo de carbono-12 (12C).
- Massa ou peso atômico: é a massa do átomo medida em unidades de massa atômica.
- Ex.: 19F – possui massa atômica= 19 u.
- Massa molecular: é a massa da molécula medida em unidades de massa atômica (u).
- Mol: é o número de átomos de carbono presente em 12 g do isótopo de carbono-12.
 Veja o Número de Avogadro:
Veja o Número de Avogadro:

Esse número é chamado de número (constante) de Avogadro e equivale a 6,023X1023.
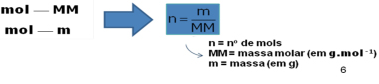
Massa molar (MM): é a massa de 1 mol de partículas (moléculas, átomos, íons). A unidade de medida é dada em g.mol-1.

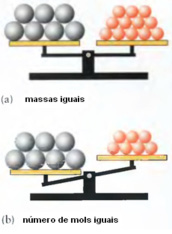
A figura acima mostra que o composto cinza possui massa molar maior que o composto laranja.
Volume molar (VM): é o volume que um mol de gás, em determinada condição de temperatura e pressão, ocupa.
Verifica-se experimentalmente que nas CNTP (condições normais de pressão e temperatura), ou seja, 0ºC e 1 atm (760 mmHg), o volume que um mol de gás ocupa é de 22,4 l.
Equação de Clapeyron:
É a Equação Geral dos Gases Ideais (perfeitos), ou, ainda, a Equação de estado dos gases, para uma massa constante de um mesmo gás (número de mols constante), vale sempre a relação:
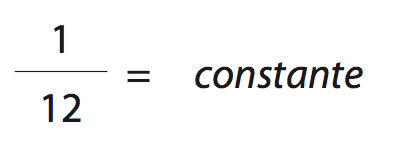
o valor da constante é nR
Tem-se então a equação completa:
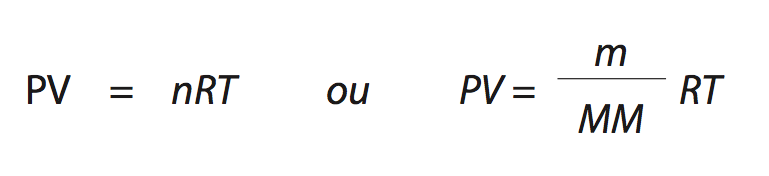
onde R é a constante universal dos gases perfeitos, n é o número de mols, m é a massa dada, MM a massa molar, T é a temperatura em Kelvin (K= ºC+273).
R é constante e a unidade depende das unidades dos outros (0,082 atm x L/K x mol ou 62,3 mmHg x L/K x mol ou 8,314 Pa x m3/K x mol).

Aula Gratuita sobre as Grandezas Químicas
Saiba mais sobre Grandezas Químicas nesta aula do canal Curso Enem Gratuito, disponível no Youtube. Após assistir, revise o que você aprendeu respondendo aos nossos desafios!
Desafios sobre Massa Atômica
Questão 1
A massa molecular da água comum (H2O) é 18 u, e da água pesada ou água deuterada (D2O) é 20 u. Essa diferença ocorre porque os átomos de hidrogênio e deutério apresentam:
a) o número de nêutrons diferentes;
b) o mesmo número de prótons;
c) os números de oxidações diferentes;
d) o mesmo número de massa;
e) o número de elétrons diferentes.
Dica 1 – Relembre tudo sobre os processos de separação de misturas homogêneas e heterogêneas em mais esta aula de revisão para a prova de Química Enem – https://blogdoenem.com.br/separacao-de-misturas-quimica-enem/
Questão 2
Um estudante muito curioso, ao sair de uma aula de química na qual aprendeu sobre mol, massa molar, resolveu medir a massa de um grafite de sua lapiseira. Sabendo que o grafite é formado apenas por átomos de carbono (C= 12 g/mol)., após uma semana, a massa do grafite diminuiu de 50 mg para 38 mg. Quantos mols de grafite (carbono) foram gastos pelo aluno durante essa semana.
a) 1,0 mol;
b) 10 mol;
c) 0,1 mol;
d) 0,01 mol;
e) 0,001 mol.
Dica 2 – Tire todas as suas dúvidas sobre os Tipos de Misturas Químicas em mais uma aula de Química Enem que preparamos para você – https://blogdoenem.com.br/sistemas-e-misturas-quimica-enem/
Questão 3
(Adaptado PEIES I – UFSM – 2007)
Uma importante cidade do Brasil é responsável pela emissão, a cada segundo, de 9,2 kg de NO2(g) para a atmosfera, provenientes de veículos automotores. O número de moléculas de NO2(g) liberadas para a atmosfera, por segundo, é aproximadamente. (N= 14 g/mol; O= 16 g/mol).
a) 0,03 x 1023
b) 6,02 x 1023
c) 0,03 x 1026
d) 6,02 x 1025
e) 1,20 x 1026
Dica 3 – Entenda tudo sobre Propriedades gerais da matéria nesta aula de Química Enem que preparamos para você – https://blogdoenem.com.br/propriedades-gerais-da-materia-quimica-enem/
Questão 4
Balões inflados com gás hélio (He= 2 g/mol), menos denso que o gás oxigênio (O2), são bastante comuns em parques de diversão. Sabendo-se que cada balão possui volume de 2,24 dm3., quantos balões podem ser enchidos com 40 g de gás hélio, nas CNTP?
a) 20 balões;
b) 2 balões;
c) 200 balões;
d) nenhum balão;
e) 2.000 balões.
Questão 5
(Adaptado Fuvest-SP)
O Brasil produz, por ano, aproximadamente, 5,0×106 toneladas de ácido sulfúrico (H2SO4), 1,2×106 toneladas de amônia (NH3) e 1,0×106 toneladas de soda cáustica (NaOH). Transformando tonelada em mols, a ordem decrescente de produção dessas substâncias será. (H= 1g/mol; S= 32 g/mol; N= 14 g/mol; Na= 23 g/mol e O= 16 g/mol).
a) H2SO4 > NH3 > NaOH;
b) H2SO4 > NaOH > NH3;
c) NH3 > H2SO4 > NaOH;
d) NH3 > NaOH > H2SO4;
e) NaOH > NH3 > H2SO4.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!

 Veja o Número de Avogadro:
Veja o Número de Avogadro: