Você lembra tudo sobre os Modelos Atômicos e a Estrutura do Átomo? Então, é hora de recordar-se de como ele é dividido. Veja esta aula gratuita porque cai direto no Enem e nos vestibulares de todo o Brasil. Confira abaixo.
O termo átomo tem origem no grego ἄτομος (atomos, “indivisível”). Significa, na origem, que seria a menor partícula capaz de identificar um elemento químico,e de participar de uma reação química. Mas, será que ainda vale? Veja nesta aula gratuita:
O estudo do átomo se iniciou na Grécia antiga com o filósofo Leucipo e seu discípulo Demócrito: para eles, o átomo era o menor componente de toda a matéria existente. Eles fizeram esta proposição 400 anos A.C. Para os gregos, naquela época, era impossível dividir o átomo em partes menores. Ao desenrolar da história, diversos cientistas e estudiosos tentaram definir o átomo quanto a sua forma, dando origem a diversas teorias sobre sua constituição física.
Para os gregos, naquela época, era impossível dividir o átomo em partes menores. Ao desenrolar da história, diversos cientistas e estudiosos tentaram definir o átomo quanto a sua forma, dando origem a diversas teorias sobre sua constituição física.
Surgiram, então, os modelos atômicos de John Dalton; de Joseph Tromson; de Ernest Rutherford; e de Niels Bohr, que aperfeiçoou o modelo anterior, criando o Modelo Bohr-Rutherford.
Comece agora pelo resumo da professora Larissa Campos, do canal do Curso Enem Gratuito:
Os Modelos Atômicos
1 – Modelo de Dalton – Após as formulações iniciais dos gregos Leucipo e Demócrito vieram as contribuições de John Dalton, na Inglaterra, em 1808, destacando no ‘Modelo Dalton’ que a Matéria seria formada por partículas muito pequenas, os ‘átomos’; Estes átomos seriam esféricos, maciços, e indivisíveis; ![]() Os átomos com as mesmas propriedades seriam parte de um ‘elemento químico’; Os elementos diferentes, portanto, seriam formados por diferentes átomos; E, ainda, que as reações químicas seriam formas de unir, separar ou de rearranjar os átomos.
Os átomos com as mesmas propriedades seriam parte de um ‘elemento químico’; Os elementos diferentes, portanto, seriam formados por diferentes átomos; E, ainda, que as reações químicas seriam formas de unir, separar ou de rearranjar os átomos.
2 – Modelo de Thomson – No final do século XIX o pesquisador inflês Joseph John Thomson derrubou a concepção de que o átomo era uma esfera indivisível, e que estava no modelo de Dalton. ![]() Para chegar a esta conclusão ele produziu um experimento om a emissão de raios catódicos, tendo como resultado a atração de partículas negativas em direção ao polo positivo de um campo elétrico externo. Ele batizou estas partículas de ‘elétrons’. Thomson sugeriu, então, o átomo esférico em equilíbrio elétrico, com cargas positivas e negativas.
Para chegar a esta conclusão ele produziu um experimento om a emissão de raios catódicos, tendo como resultado a atração de partículas negativas em direção ao polo positivo de um campo elétrico externo. Ele batizou estas partículas de ‘elétrons’. Thomson sugeriu, então, o átomo esférico em equilíbrio elétrico, com cargas positivas e negativas.
3 – Modelo de Rutherford – No início do Século XX o neozelandês Ernest Rutherford derrubou os conceitos anteriores ao demonstrar através de um experimento de que o átomo não era ‘maciço’.
Rutherford bombardeou lâminas finíssimas de ouro com partículas alfa, e verificou que algumas passavam ‘direto’ e que outras eram desviadas. 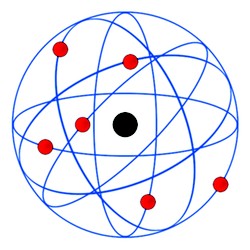 Assim, Rutherford deduziu que os átomos teriam um ‘núcleo’ mais consistente e de carga positiva, e que em torno dele orbitavam os elétrons em movimento circular, e de carga negativa (veja a imagem acima).
Assim, Rutherford deduziu que os átomos teriam um ‘núcleo’ mais consistente e de carga positiva, e que em torno dele orbitavam os elétrons em movimento circular, e de carga negativa (veja a imagem acima).
A– As diferentes orbitas circulares em torno do Núcleo consistiam-se em ‘camadas eletrônicas’, sendo cada uma delas com o seu próprio nível de energia. Ou seja, uma órbita tem diferente nível energia em relação às demais.
B- Quando os elétrons se movimentam numa mesma camada eletrônica eles não absorvem nem emitem energia espontaneamente.
C– Ao receber energia, o elétron pode saltar para outra órbita, mais energética. Dessa forma, o átomo fica instável, pois o elétron tende a voltar à sua orbita original.
Quando o átomo volta à sua órbita original, ele devolve a energia que foi recebida em forma de luz ou calor. 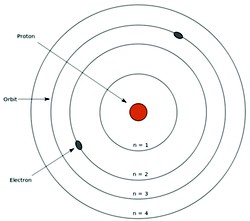 Veja na ilustração acima (fonte e imagem: Globo Educação).
Veja na ilustração acima (fonte e imagem: Globo Educação).
A Classificação dos Átomos
Os átomos podem possuir o mesmo número de massa, de elétrons, de prótons e de nêutrons veja a seguir, como cada uma dessas situações é chamada:
- Isoeletrônicos: São os átomos que possuem a mesma quantidade de elétrons;
- Isóbaros: São os átomos que possuem o mesmo número de massa;
- Isotonos: São os átomos que possuem o mesmo número de neutros;
- Isotopos: São os átomos que possuem o mesmo número de prótons, mas, diferem na quantidade de nêutrons.
A Estrutura do Átomo
Entenda mais um pouco sobre a Estrutura do átomo: Os átomos são compostos de, pelo menos, um próton, um elétron e um nêutron.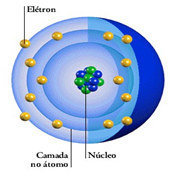 Os prótons e os nêutrons formam o núcleo do átomo, enquanto os elétrons estão distribuídos no espaço em torno do núcleo.
Os prótons e os nêutrons formam o núcleo do átomo, enquanto os elétrons estão distribuídos no espaço em torno do núcleo.
Assista agora ao vídeo do Curso Enem Gratuito sobre Introdução ao átomo e saia na frente nas questões do Enem e dos vestibulares.
Veja na tabela as características das partículas que compõem o átomo.
|
Partícula |
Símbolo |
Carga |
Massa, Kg |
|
elétron |
e– |
-1 |
9,109×10-31 |
|
próton |
p |
+1 |
1,673×10-27 |
|
nêuton |
n |
0 |
1,675×10-27 |
O número de prótons de um átomo é chamado de número atômico e é representado pela letra Z.
O número de massa de um átomo corresponde à soma do número de prótons (Z) com o número de neutros (n), e é representada pela letra A. Assim temos: A=Z+n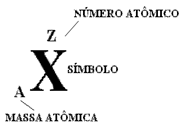
Vamos deixar mais claro? Então veja o exemplo:
- Se o átomo de potássio (K) apresenta número de massa 39, qual é o seu número de nêutrons, sabendo que o seu número atômico é igual a 19?
- Dados:
- A=39
- Z = 19
- Então: A=Z+n → 39 = 19 + n →n=39-19 → n=20
- Portanto o número de neutros é igual a 20.
Dica 1 – Veja o que mais cai em Química no Enem, e as principais dicas: 
Dica 2 – Veja também outro assunto de química bastante cobrado no enem e nos vestibulares que ligações químicas. Não deixe essa chance passar! https://blogdoenem.com.br/enem-ligacoes-quimicas/
Exercício sobre o Átomo
Gostou? Que tal um desafio?
(UFRJ)
Alguns estudantes de Química, avaliando seus conhecimentos relativos a conceitos básicos para o estudo do átomo, analisam as seguintes afirmativas:
I. Átomos isótopos são aqueles que possuem mesmo número atômico e números de massa diferentes.
II. O número atômico de um elemento corresponde à soma do número de prótons com o de nêutrons.
III. O número de massa de um átomo, em particular, é a soma do número de prótons com o de elétrons.
IV. Átomos isóbaros são aqueles que possuem números atômicos diferentes e mesmo número de massa.
V. Átomos isótonos são aqueles que apresentam números atômicos diferentes, número de massas diferentes e mesmo número de nêutrons.
Esses estudantes concluem, corretamente, que as afirmativas verdadeiras são as indicadas por:
a) I, III e V
b) I, IV e V
c) II e III
d) II, III e V
e) II e V
Resposta: B
II. (INCORRETA) O número atômico de um elemento corresponde ao número de prótons.
III. (INCORRETA) O número de massa de um átomo é resultante da soma do número de prótons e nêutrons, dado pela fórmula A = p + n .
Dica 4 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.




