Confira os Modelos desde Leucipo e Demócrito, Johon Dalton, Thomson, Ernst Rutherford, e até a proposta atual de Niels Bohr. Domine a Estrutura do Átomo para entender como funcionam os níveis de energia e o diagrama de Linus Pauling.
É hora de revisar fundamentos da Química com os Modelos Atômicos, a Estrutura do Átomo e as Partículas. O foco desta aula é que você chegue com tudo para gabaritar Química no Enem e no Vestibular. Vamos lá!
Os Modelos Atômicos
A origem de tudo, com Demócrito e Leucipo (Século V a.C.) – Foram estes dois filósofos da Grécia Antiga que primeiro difundiram a idéia de que toda e qualquer matéria seria formada por minúsculas partículas.
Estas partículas, que na época eles teorizavam a respeito, mas que não podiam ainda chegar até elas porque não dispunham de instrumentos,foram trabalhadas por ele como ‘indivisíveis’, e denominadas por átomos (do grego, indivisível).Foi o primeiro conceito sobre a Estrutura do Átomo. Esta foi a formulação original para chegar ao que hoje a ciência conhece por Modelos Atômicos e Partículas. Veja como se formou na origem a a palavra átomo: A = não + Tomos = divisão
Esta foi a formulação original para chegar ao que hoje a ciência conhece por Modelos Atômicos e Partículas. Veja como se formou na origem a a palavra átomo: A = não + Tomos = divisão
A Estrutura do Átomo
– Somente no ano 1803, na Inglaterra, mais de dois mil anos depois, é que surge uma grande inovação acerca do que seria o Átomo e a sua composição. A proposta foi apresentada por John Dalton, com a Teoria Atômica conhecida como modelo “bola de bilhar”, ou Teoria Dalton.
O Modelo Atômico de John Dalton
John Dalton estabeleceu a proposta de que os diferentes ‘tipos’ de Átomo teriam pesos diferentes, características específicas, e propriedades distintas, constituindo-se em elementos diferentes e que poderiam se combinar e recombinar, levando ao que seriam ‘átomos compostos’. Era uma nova proposta para a Estrutura do Átomo.
A evolução pós Dalton: A partir desta premissa ,Dalton abriu o caminho para se chegar aos ‘pesos atômicos’ relativos aos elementos que até então eram conhecidos. Foi uma grande contribuição que abriu caminho para emergirem as modernas teorias sobre Modelos Atômicos e Partículas.
As Leis de Dalton
As Leis ponderais de Dalton estavam ancoradas nos seguintes Postulados: ![]() 1- Toda matéria é formada por entidades extremamente pequenas, os átomos.
1- Toda matéria é formada por entidades extremamente pequenas, os átomos.
2- Os átomos são indivisíveis e indestrutíveis.
3- A formação de materiais se dá por meio de diferentes associações entre átomos iguais ou não.
Bases e comprovação experimental propostas por Dalton com as Leis Ponderais: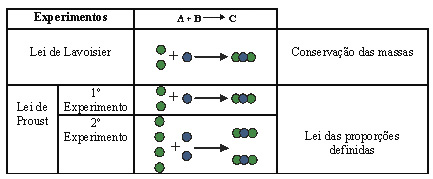
.
Resumo sobre o modelo de Dalton:
Veja a Estrutura do Átomo de John Dalton com o professor Felipe Sobis, do canal do Curso Enem Gratuito:
.
A nova ruptura com o Modelo de Thomson
Quase 100 anos depois, em 1897, surge a Teoria atômica de Thomson (modelo “pudim com passas”). Os tempos já eram outros, e muita tecnologia já tinha sido desenvolvida ao longo do século que permitiram já fazer experimentos que propiciaram avançar bastante.
O conhecimento sobre o uso da eletricidade e experimentos com gases injetados em válvulas de vidro (ampolas de Crookes), dotadas de ‘anodo’ e ‘catodo’ permitiram coletar dados sobre raios catódicos que partiam do anodo para o catodo.
John Thomson observou que os raios catódicos eram sensíveis a um campo magnético, determinou que os raios, na verdade, eram dotados de uma carga negativa, e que seriam uma partícula do átomo, e os denominou de ‘elétrons’. E, em seguida, que o átomo teria, então, para manter o seu equilíbrio, partículas com carga negativa e com carga positiva.
Resumo sobre o Modelo de Thomson
As principais contribuições e postulados de Thomson:
1- Descoberta dos raios catódicos (Experimento de Thomson)
2- Descoberta da radioatividade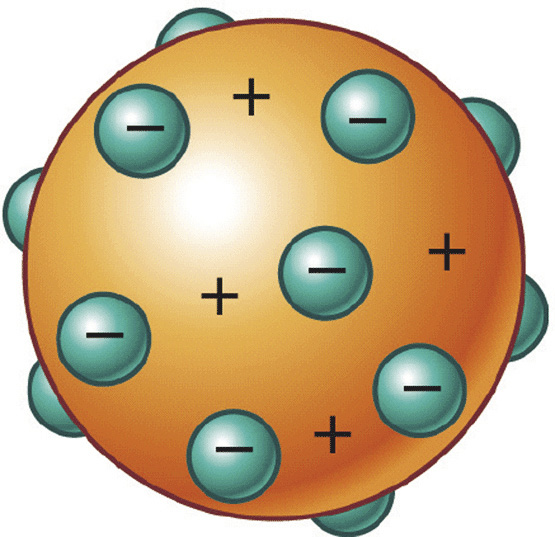 Veja na imagem acima o Modelo “pudim com passas”
Veja na imagem acima o Modelo “pudim com passas”
Os Postulados de Thomson:
1- O átomo é formado por uma “pasta” positiva “recheada” pelos elétrons de carga negativa.
2- O átomo é eletricamente neutro.
Teoria atômica de Ernest Rutherford (“modelo planetário”)
Modelo de Rutherford – No início do Século XX o neozelandês Ernest Rutherford derrubou os conceitos anteriores da Estrutura do Átomo ao demonstrar através de um experimento de que o átomo não era ‘maciço’.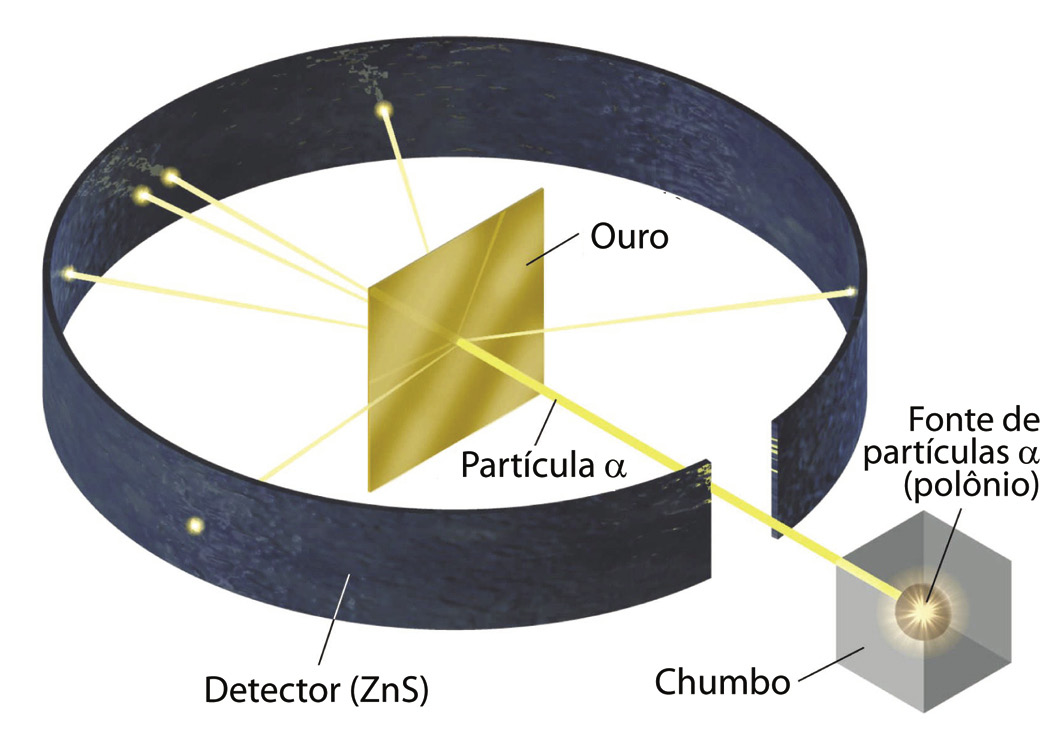
Rutherford bombardeou lâminas finíssimas de ouro com partículas alfa, e verificou que algumas passavam ‘direto’ e que outras eram desviadas.
Assim, Rutherford deduziu que os átomos teriam um ‘núcleo’ mais consistente e de carga positiva, e que em torno dele orbitavam os elétrons em movimento circular, e de carga negativa (veja a imagem).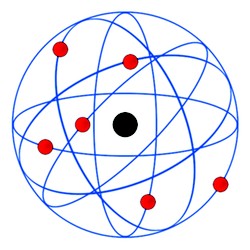
1- O átomo é formado por um núcleo central positivo, pequeno e denso (o qual possui quase toda a massa do átomo) e uma região externa (eletrosfera) onde se situam os elétrons (carga negativa) que ficam girando ao redor do núcleo, como planetas ao redor do sol.
Problemas do modelo: Os elétrons (negativos) girando ao redor do núcleo denso (positivo) seriam atraídos por forças eletrostáticas e destruiria o átomo.
O Modelo de Niels Bohr
– Teoria atômica de Rutherford-Bohr (ou apenas Bohr) – Bohr-Rutherford – Em 1913 o cientista dinamarquês Niels Bohr perfeiçoou o modelo de Rutherford sobre a Estrutura do Átomo ao propor que os elétrons realizavam seus movimentos em diferentes órbitas em torno do núcleo.
Nestes movimentos, os elétrons poderiam, inclusive, ‘subir’ ou ‘descer’ de órbitas em torno do núcleo. Bohr inovou na ciência do átomo com três postulados que se tornaram clássicos:
Os níveis orbitais
1 – As diferentes orbitas circulares em torno do Núcleo consistiam-se em ‘camadas eletrônicas’, sendo cada uma delas com o seu próprio nível de energia. Ou seja, uma órbita tem diferente nível energia em relação às demais.
2- Quando os elétrons se movimentam numa mesma camada eletrônica eles não absorvem nem emitem energia espontaneamente.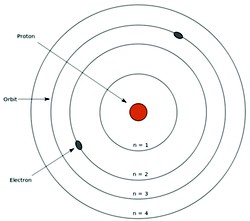
3- Ao receber energia, o elétron pode saltar para outra órbita, mais energética. Dessa forma, o átomo fica instável, pois o elétron tende a voltar à sua orbita original.
Quando o átomo volta à sua órbita original, ele devolve a energia que foi recebida em forma de luz ou calor. Veja na ilustração a seguir (fontes de texto e de imagens: Globo Educação).
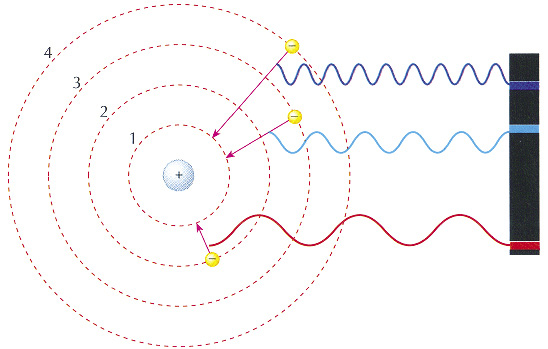
Postulados do Modelo de Rutherford-Bohr
1- O átomo é formado por um núcleo (prótons e nêutrons) e níveis de energia (ou camadas) quantizados (onde estão os elétrons).
2- Os elétrons são distribuídos em sete camadas (períodos da tabela periódica) denominadas: K, L, M, N, O, P e Q, com no máximo 2, 8, 18, 32, 32, 18 e 2 elétrons, respectivamente.
Resumo sobre o Modelo de Bohr
A Teoria atômica de Sommerfield
Postulados
1- Cada nível de energia n possui n órbitas circulares e (n-1) órbitas elípticas.
2- Cada nível de energia na eletrosfera está dividido em subníveis (s,p,d,f…) de energia.
Modelo dos orbitais atômicos
• Princípio da dualidade partícula-onda (De Broglie)
• Princípio da incerteza de Heisenberg – não é possível calcular a posição e a velocidade de um elétron, num mesmo instante.
• Orbital – região do espaço ao redor do núcleo onde é máxima a probabilidade de encontrar um elétron.
Partículas Fundamentais
Átomo – Estrutura básica do átomo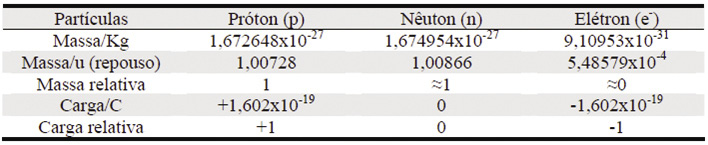
Conceitos sobre o átomo
• Número Atômico (Z): quantidades de prótons. Em um átomo neutro o número de prótons é igual ao de elétrons. Z=p=e
• Número de Massa (A): a soma de prótons e nêutrons de um átomo (logo que a massa do elétron é insignificante). A = Z + n
Representação de um átomo
![]()
Semelhança atômica
• ISÓTOPOS: mesmo número de prótons.(apresentam iguais propriedades químicas e físicas diferentes)
![]()
• ISÓBAROS: mesmo número de massa. (apresentam propriedades químicas e físicas diferentes)
![]()
• ISÓTONOS: mesmo número de nêutrons. (apresentam propriedades químicas e físicas diferentes)
![]()
• ISOELETRONICOS: mesmo número de elétrons. (apresentam propriedades químicas e físicas diferentes)
![]()
• ÍONS: são átomos que ganharam ou perderam elétrons.

O Diagrama de Linus Pauling
• Inicialmente podemos ordenar os subníveis em linhas verticais de tal modo que todos os subníveis s permaneçam na mesma vertical e os demais subníveis p, d, f também.
• Os número de elétrons que cada camada comporta será dividido pelos subníveis de acordo com a capacidade dos mesmos.
Nessa ordem teremos o seguinte Diagrama: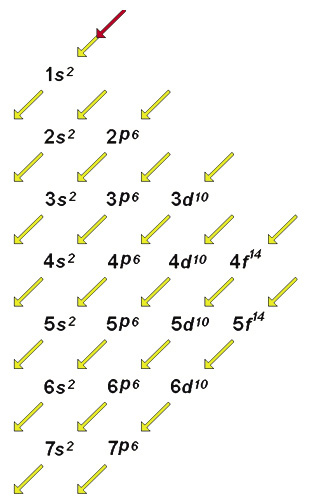 Lembre-se que cada subnível comporta uma quantidade determinada de elétrons.
Lembre-se que cada subnível comporta uma quantidade determinada de elétrons.
Usando o Diagrama de Linus Pauling.
• Devemos observar o número atômico do átomo que vamos trabalhar, pois este é igual ao número de elétrons. A partir deste fator faremos a distribuição eletrônica.
• Distribua os elétrons de cima para baixo em diagonal, respeitando a ordem crescente de energia dos subníveis;
• Coloque o numero máximo de elétrons em cada subnível deixando para o último subnível o que resta para totalizar os elétrons do átomo.
• Some os elétrons distribuídos para não ultrapassar o valor do número atômico.
Ex: 6C = 1s2 2s2 2p2
11Na = 1s2 2s2 2p6 3s1
Após a distribuição dos elétrons em subníveis, podemos identificar as camadas e subcamadas de cada átomo, bem como a quantidade de elétrons contida nas mesmas.
Desafios sobre a Estrutura do Átomo
Questão 01
Um cozinheira ao preparar as refeições, deixou cair sal de cozinha (NaCl) na chama do fogão, logo a chama mudou de cor (passou de azul a amarela) por alguns instantes. A mudança de cor da chama deve-se promoção de um elétron de uma camada mais interna a uma mais externa, e posterior regressão deste a camada original com emissão de energia.
Como se sabe, a cor amarela indica que apenas uma quantidade determinada de energia foi emitida.
Logo esse fato está relacionado a:
a) energia quantizada do elétron referida pela teoria atômica de Dalton
b) o elétron se encontra em todas as regiões do átomo como no modelo atômico de Thomson.
c) o elétron possui energia quantizada conforme explicado pelo modelo atômico de Rutherford-Bohr.
d) o átomo perde energia e diminui e aumenta de tamanho constantemente.
e) o átomo é indivisível segundo o modelo atômico de Bohr.
Questão 02
Desde as primeira observações feitas por Demócrito no século V a.C, sobre átomos, o surgimento de novas descobertas experimentais ao longo dos séculos permitiram a formulação de modelos atômicos cada vez mais completos.
As afirmativas indicam determinados fenômenos que podem ser explicados de forma satisfatória por um certo modelo atômico, Exceto:
a) o espalhamento de partículas α ao passarem por uma fina placa de ouro- Modelo de Thomson
b) a formação de raios catódicos em um tubo de televisão – Modelo de Thomson
c) a não observação de um colapso nuclear – Modelo de Bohr
d) a massa atômica esta concentrada no núcleo – Modelo de Rutherford
e) o espectro de emissão de energia de um metal não é contínuo – modelo de Bohr
Questão 03
(PEIES – UFSM) A classificação periódica moderna, baseada na tabela de Mendeleev, apresenta os elementos químicos dispostos em ordem crescente de seus números atômicos, usando como referência o isótopo 12 do carbono.
Quase 99% do carbono encontrado na natureza é 12C, mas existem outros isótopos, como 11C. 13C e 14C.
O número de massa do isótopo do carbono que contém 6 prótons, 6 elétrons e 7 nêutrons é.
a) 6
b) 12
c) 13
d) 18
e) 19
Questão 04
(PEIES – UFSM) Os vidros borossilicatados são obtidos pela adição de óxido de alumínio e óxido de boro à sílica e podem suportar aquecimento e posterior resfriamento sem trincar.
O elemento alumínio apresenta um único tipo de isótopo natural, 27Al13.
O íon 27Al133+ possui
a) 27 nêutrons, 27 prótons e 13 elétrons.
b) 27 nêutrons, 13 prótons e 10 elétrons.
c) 14 nêutrons, 13 prótons e 10 elétrons.
d) 14 nêutrons, 10 prótons e 13 elétrons.
e) 13 nêutrons, 14 prótons e 10 elétrons.
Dica 3 – Veja o que mais cai em Química no Enem, e as principais dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Questão 05
(Cesgranrio) A distribuição eletrônica do átomo 26Fe56, em camadas é:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d6
b) 1s2 2s2 2p6 3s23p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2
c) K – 2 L – 8 M – 16
d) K – 2 L – 8 M – 14 N – 2
e) K – 2 L – 8 M – 18 N – 18 O – 8 P – 2
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!