O diagrama de Linus Pauling é a representação da distribuição eletrônica através de níveis e subníveis de energia dos átomos. Entenda como esse diagrama funciona!
Vamos revisar como é feita a distribuição eletrônica utilizando o diagrama de Linus Pauling. Em cinco minutos você aprende as camadas eletrônicas e os níveis de energia. Estude com a gente para os vestibulares e Enem.
O que é o diagrama de Linus Pauling
O diagrama de Linus Pauling nada mais é do que um método de distribuir os elétrons na eletrosfera do átomo e dos íons. Este método foi desenvolvido pelo químico norte-americano Linus Pauling (1901-1994).
De acordo com Pauling, os elétrons estão dispostos nos átomos em ordem crescente de energia. Isso porque para saltar de uma camada interna para uma camada mais externa, o elétron deve receber energia e liberá-la na forma de luz ou onda eletromagnética para retornar à camada original.
Níveis e subníveis de energia
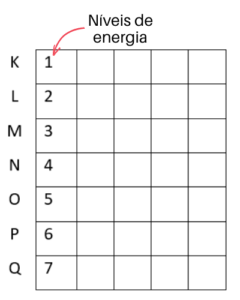
Para entender como se faz a distribuição dos elétrons no diagrama de Linus Pauling, vamos precisar lembrar do modelo atômico de Bohr. De acordo com Bohr, os elétrons estão localizados na chamada elestrosfera, região que fica ao redor do núcleo do átomo. Além disso, a eletrosfera possui camadas que representam seus níveis de energia. Assim, as camadas K, L, M, N, O, P e Q constituem os 1º, 2º, 3º, 4º, 5º, 6º e 7º níveis de energia, respectivamente.
Cada um desses níveis de energia suporta um determinado número máximo de elétrons:
| Nível de energia | K | L | M | N | O | P | Q |
| Posição na eletrosfera | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Nº máximo de elétrons | 2 | 8 | 18 | 32 | 32 | 18 | 8 |
Perceba que o nível K suporta 2 elétrons, o nível L suporta 8 elétrons e assim sucessivamente.
Algum tempo depois dos estudos de Bohr, cientistas descobriram que os níveis de energia são formados por subdivisões chamadas de subníveis. Os subníveis são designados pelas letras minúsculas s, p, d, f. Eles também abrigam um número máximo de elétrons:
| Subnível | s | p | d | f |
| Nº máximo de elétrons | 2 | 6 | 10 | 14 |
| Representação | s2 | p6 | d10 | f14 |
Relembre de onde vem os níveis e subníveis de energia com a videoaula sobre números quânticos com o prof. Sobis:
Como fazer o diagrama de Linus Pauling
Quando estamos na escola, geralmente temos acesso ao diagrama de Linus Pauling quando precisamos fazer a distribuição de um elemento químico. No entanto, pode ser que no Enem, num vestibular ou em alguma outra prova você precise montá-lo. Por isso vamos demonstrar o passo a passo de como fazer o diagrama de Linus Pauling.
O primeiro passo é fazer uma coluna numerada com 7 linhas, uma para cada nível de energia. Se você quiser, pode colocar a letra correspondente ao lado para se orientar:
Em seguida, vamos distribuir os elétrons pelos subníveis obedecendo o número suportado em cada nível. Para isso, você deve seguir a ordem dos subníveis, que é s, p, d e f. O número de elétrons será representado de forma subscrita à letra de cada subnível.
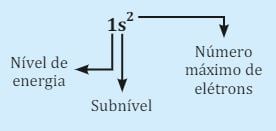
Vamos começar pela linha do nível K. Como esse nível de energia suporta dois elétrons, vamos colocá-los no subnível s, que também suporta dois elétrons. Essa distribuição é representada assim: 1s².
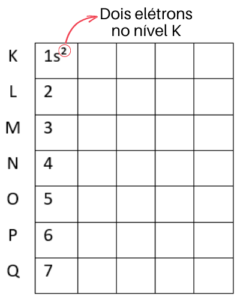
Agora que o nível K está completo, vamos para o L, que suporta 8 elétrons. Começamos colocando o primeiro subnível ao lado do número 2. Mas, ainda faltam 6 elétrons e o subnível s não suporta mais nenhum. Por isso vamos para o subnível p, onde cabem mais 6 elétrons. Veja como fica no diagrama de Linus Pauling:
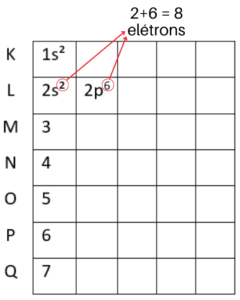
Já no nível M cabem 18 elétrons. Portanto, colocaremos 2 no subnível s, 6 no subnível p e mais 10 no subnível d. Assim iremos obter os 18 elétrons:
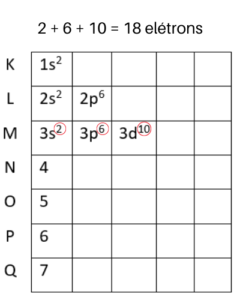
O restante das camadas segue a mesma lógica vista até aqui. Quando todos os níveis estiverem preenchidos, obtemos o diagrama de Linus Pauling completo:
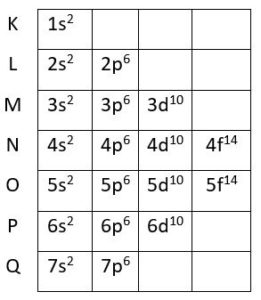
Se você ainda está confuso sobre como montar o cronograma de Linus Pauling, assista a esta videoaula do Curso Enem Gratuito que o prof. Sobis explica tudo direitinho:
Distribuição eletrônica no diagrama de Linus Pauling
A fim de fazer a distribuição de elétrons de um átomo, você deve seguir a orientação das setas da imagem abaixo. Elas indicam o sentido que o diagrama deve ser lido, que é de cima para baixo, e nos fornece a ordem crescente dos subníveis de energia.
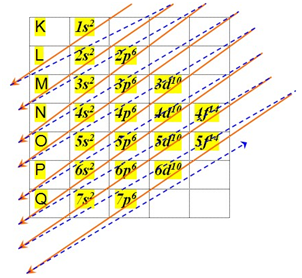
Transcrevendo o caminho das setas, a ordem do diagrama de Linus Pauling é a seguinte:
1s2 2s2 2p6 3s2 3p6 4s2 3d104p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Para fazer a distribuição eletrônica de um átomo, você deve atentar para o seguinte:
- O número atômico do átomo é igual ao número de elétrons. É a partir deste fator que faremos a distribuição eletrônica.
- Coloque o numero máximo de elétrons em cada subnível deixando para o último subnível o que resta para totalizar os elétrons do átomo.
- Some os elétrons distribuídos para não ultrapassar o valor do número atômico.
Após a distribuição dos elétrons em subníveis, podemos identificar as camadas e subcamadas de cada átomo, bem como a quantidade de elétrons contida nas mesmas.
Exemplo
Para que você entenda como a distribuição eletrônica é feita, vamos ver o exemplo do átomo de ferro (Z=26) no diagrama de energia: Fe: Z = 26.
Como o número atômico do ferro é 26, temos 26 elétrons, pois está no seu estado neutro. Escrevendo a distribuição eletrônica em ordem crescente de energia, temos:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Os elétrons mais energéticos do átomo de ferro no estado fundamental são os que possuem o estado de energia: 3d6.
A camada de valência (a última camada), contém os elétrons mais externos, que são os elétrons de valência: 4s2. Logo, o átomo de ferro possui 2 elétrons de valência no nível 4, no estado fundamental.
Exercícios sobre diagrama de Linus Pauling
1 – (UERJ/2019)
Recentemente, cientistas conseguiram produzir hidrogênio metálico, comprimindo hidrogênio molecular sob elevada pressão. As propriedades metálicas desse elemento são as mesmas dos demais elementos do grupo 1 da tabela de classificação periódica.
Essa semelhança está relacionada com o subnível mais energético desses elementos, que corresponde a:
a) ns1
b) np2
c) nd3
d) nf4
2 – (UNIFICADO RJ/2016)
A distribuição eletrônica, no estado fundamental, do íon Al3+ é
a) 1s2 2s2 2p6 3s1
b) 1s2 2s2 2p6
c) 1s2 2s2 2p6 3s1 3p2
d) 1s2 2s2 2p9
e) 1s2 2s2 2p6 3s2 3p1
3 – (UNITAU SP/2017)
A configuração eletrônica do Br (Z = 35) é
a) 1s22s22p63s23p64s23d104p5
b) 1s22s22p63s23p64s24p65s25p64d1
c) 1s22s22p63s23p64s24p64d9
d) 1s22s22p63s23p64s24p65s25p66s1
e) 1s22s22p63s23p64s24p63d9
GABARITO:
- A
- B
- A

